Das vielseitige Gas Ozon ist ebenso begehrt wie es ungeliebt ist. Im ersten Teil dieses Artikels erfährst du, was Ozon eigentlich ist und warum es in unserer Atemluft in grösseren Mengen nichts zu suchen hat. Dieser Teil beschäftigt sich mit Ozon, ohne welches wir nicht leben könnten und mit den Möglichkeiten dieses Gases uns zu heilen.
Wann und wo ist Ozon für uns lebenswichtig?
Im Jahre 1985 versetzte die Entdeckung eines wachsenden Ozonlochs über der Antarktis, der südlichsten Region der Erde, die Menschheit in Aufruhr. Denn schon damals wusste man, dass Ozon in der Stratosphäre für uns lebenswichtig ist, und Wissenschaftler (z.B. Crutzen und Molina&Rowland) hatten bereits seit 15 Jahren eine Ausdünnung der Ozonschicht aufgrund von menschlichen „Hinterlassenschaften“ vorausgesagt. Mit einem Loch hatte hingegen niemand gerechnet. Aber wie kann eine Luftschicht, noch dazu in einer mittleren Schicht der Atmosphäre, ein Loch haben?
Für die Antwort müssen wir uns in grosse Höhe begeben: In der etwa 500km dicken Erdatmosphäre nimmt die Stratosphäre den Bereich von etwa 15 bis 50 Kilometern Höhe ein. Direkt darunter liegt die Troposphäre, jene Luftschicht, die wir atmen. Beide Schichten sind aus physikalischen Gründen relativ scharf voneinander getrennt, d.h. Inhaltsstoffe einer Schicht können nur unter erschwerten Bedingungen in die andere Schicht gelangen.
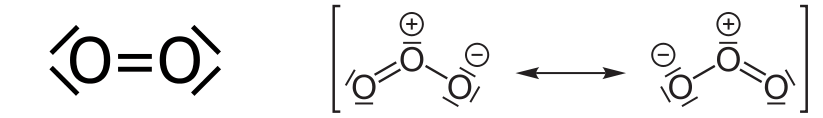
Die Schichten oberhalb der Stratosphäre sind so dünn, dass energiereiche UV-C-Strahlung (etwas über UV-Strahlung und ihre Einteilung findest du in diesem Artikel) hindurchdringt und in der Stratosphäre Ozon erzeugt. UV-C-Strahlung kann nämlich Sauerstoff-Moleküle spalten:
Aus dem ersten Teil weisst du ja bereits, dass Sauerstoff-Atome nicht lange allein bleiben, sondern sich schnellstens etwas zum Reagieren suchen:
Genauso kann Ozon durch UV-B-Strahlung, die in der Stratosphäre auch reichlich vorhanden ist, gespalten werden:
Die Energie der UV-Strahlung wird dabei teilweise für die Umgruppierung der Atome verwendet, teilweise durch Anschubsen eines beliebigen dritten Moleküls als Wärme weitergegeben. So führt allein das Vorhandensein von Sauerstoff (O2) zum Spalten in der Stratosphäre dazu, dass die UV-C-Strahlung die Erdoberfläche gar nicht erreicht, während das Ozon den entscheidenden Teil der UV-B-Strahlung aufhält. Nur deshalb können wir uns an der Erdoberfläche bewegen, ohne innerhalb kürzester Zeit einen Sonnenbrand zu bekommen oder schlimmere Hautschäden zu erleiden.
Zwischen der Entstehung und dem Abbau von Ozon stellt sich bei UV-Lichteinfall ein Gleichgewicht ein. In der mittleren Stratosphäre gibt es noch genug UV-C-Strahlung, die Ozon entstehen lässt, während ein Teil der UV-B-Strahlung bereits vom Ozon darüber aufgehalten worden ist. So liegt hier das Gleichgewicht am weitesten auf der Seite des Ozons: Die Ozon-Konzentration ist in der mittleren Stratosphäre am höchsten.
Können wir die Ozonschicht in der Stratosphäre direkt wahrnehmen?
Manchmal können wir das Ozon in der Stratosphäre sogar sehen. Bei Tag ist der klare Himmel blau, weil das einfallende Sonnenlicht vom Luftsauerstoff O2 so gestreut wird, dass hauptsächlich blaues Licht bei uns ankommt. Morgens vor Sonnenaufgang und abends nach Sonnenuntergang, wenn kein direkt einfallendes Licht mehr gestreut wird, zeigt sich, dass Ozon auch sichtbares Licht, vornehmlich im gelben, orangen und roten Bereich, absorbiert. Das blaue Licht bleibt übrig und beschert uns regelmässig im ersten und letzten Licht des Tages eine „blaue Stunde“.
Neben zahlreichen Poeten hat sich der Geophysiker Edward O. Hulburt, der diesen Zusammenhang 1952 erstmals erkannte, voll Staunen geäussert:
„Der nichtsahnende Beobachter, der während des Sonnenuntergangs auf dem Rücken liegend in den klaren Himmel schaut, sieht nur, dass der Himmel über ihm, der vor dem Sonnenuntergang blau war, dasselbe leuchtende Blau beibehält, während die Sonne untergeht und es anschließend während der Dämmerung immer dunkler wird. Er ist sich nicht bewusst, dass die Natur, um dieses anscheinend so selbstverständliche und naheliegende Ergebnis zu produzieren, recht großzügig ganz tief in die optische Trickkiste gegriffen hat.“
Warum hat die Ozonschicht ein Loch?
Sauerstoff gibt es in der Stratosphäre stets genug, sodass wir uns hier unten in der Troposphäre wegen UV-C-Strahlung keine Sorgen machen müssen. UV-B-Strahlung wird hingegen nur absorbiert, wenn es auch Ozon hat! Deshalb wird die Dicke – oder besser Dichte – der Ozonschicht in der Stratosphäre seit einigen Jahrzehnten vermessen und genau überwacht.
Die Dicke der Ozonschicht wird in Dobson-Units (DU) gemessen, einer Einheit, die nach Gordon Dobson, dem Erfinder des zur Messung der Schichtdicke verwendeten Spektralphotometers, benannt ist. 100 DU entsprechen dabei einer 1 mm dicken Schicht aus reinem Ozon auf Meereshöhe, die sich in Wirklichkeit aber auf die ganze Stratosphäre verteilt [1]. Das „Loch“ in der Ozonschicht ist somit auch kein Loch im eigentlichen Sinne, sondern vielmehr ein Bereich, in dem weniger Ozon in der ganzen Stratosphäre zu finden ist. Die durchschnittliche „gesunde“ Ozonschicht der Erde hat übrigens eine Dichte in der Grössenordnung von 300 – 500 DU.
Die Ozonschicht ist aber weder gleichmässig noch gleichbleibend dick.
Da Ozon erst durch (UV-)Licht entsteht, ist die Ozonschicht immer da, wo die Sonne ist. Und die scheint am intensivsten am Äquator, sodass dort am meisten Ozon gebildet wird. Von da aus wird das Ozon in Richtung der Pole verteilt: Im Frühling auf der Nordhalbkugel vornehmlich in Richtung Nordpol, im Herbst der Nordhalbkugel, wenn auf der Südhalbkugel Frühling herrscht, dem Licht folgend in Richtung Südpol. So ist absehbar, dass die Ozonschicht nahe der Pole schon von Natur aus dünner ist als über dem Äquator.
Was die Antarktis anfällig für ein Ozonloch macht
Am Südpol bildet sich zudem im Polarwinter ein wirklich sehr kalter Luftwirbel. Dieser Polarwirbel kreist über der Antarktis weitgehend ungestört vor sich hin, sodass seine Temperatur ohne Zustrom wärmerer Luft von aussen auf bis zu -80°C sinken kann. Am Nordpol gibt es einen ähnlichen Wirbel, doch da es rund um die Arktis viele Berge gibt, die die Luftströmung aufmischen und so den Zustrom wärmerer Luft ermöglichen, wird dieser längst nicht so kalt.
Bei den extrem niedrigen Temperaturen im Süd-Polarwirbel können in der Stratosphäre Salpetersäure (HNO3) und Wasser zu Eiswolken gefrieren (normalerweise ist die Stratosphäre zu trocken für die Entstehung von Wolken). An diesen Wolken sammeln sich Stickstoff- und Chlorverbindungen wie Chlornitrat (ClONO2) und hypochlorige Säure (HClO) an. Stickstoff- und Chlorverbindungen, aus welchen diese Stoffe entstehen können, werden in der Natur von aktiven Vulkanen oder Pflanzen freigesetzt (aber das ist eine andere Geschichte). In den Stratosphärenwolken können Chlornitrat und hypochlorige Säure den langen, lichtlosen Polarwinter ohne Reaktion überdauern.
Erst wenn im Süd-Frühling die Sonne aufgeht (und dann geht sie für Monate nicht mehr unter!) und UV-Licht auf die Wolken fällt, werden die darin gelagerten Stoffe schnell gespalten:
Teilchen wie das ClO• nennt man Radikale, und das völlig zu Recht. Der Punkt in der Formel bedeutet ein einsames Elektron in der Elektronenhülle des Teilchens. Und da die Elektronen eines Atoms oder Moleküls sehr viel lieber zweisam sind, sucht sich das Teilchen mit radikalem Eifer etwas zum Reagieren, um ein weiteres Elektron zu erhalten. Und dabei lassen sie nicht selten andere Radikale zurück:
Richtig: Atomarer Sauerstoff ist auch ein Radikal, das z.B. durch Abspaltung von einem NO2-Molekül durch UV-Strahlung (s. Teil 1 dieses Artikels) entsteht.
Die so entstehenden Chlor-Radikale greifen wiederum Ozon an:
Es entsteht ein neues ClO•-Radikal, welches wiederum zu einem Chlor-Radikal reagieren und ein neues Ozon-Molekül angreifen kann! Chlor-Radikale reagieren also nicht nur leicht mit Ozon. Zudem können wenige Chlor-Radikale, die immer wieder in den Reaktionen Verwendung finden, viele Ozon-Moleküle abbauen. Chlor-Radikale wirken als Katalysator auf den Ozonabbau!
Die extreme Kälte des Polarwirbels im Polarwinter fördert also die Anreicherung von Stoffen in der Stratosphäre, die bei Einwirkung von Sonnenlicht Radikale bilden, welche als Katalysator auf den Abbau von Ozon wirken. Deshalb ist die Ozonschicht über der Antarktis im Süd-Frühling schon seit Beginn der Messungen etwas dünner als anderswo.
Wie haben wir uns daraus ein Problem geschaffen?
Ab den 1930er Jahren wurden sogenannte FCKW technisch hergestellt und vermehrt als Kältemittel in Kühlschränken und als Treibgas für Sprühdosen eingesetzt. FluorChlorKohlenWasserstoffe, bzw. nach den Spielregeln der Chemiker, die ihre Stoffe in alphabetischer Reihenfolge benennen, CFKW, sind Kohlenwasserstoffe, bei denen einige oder alle Wasserstoff-Atome durch Fluor- bzw. Chloratome ersetzt sind. Solche Verbindungen sind unter normalen Umständen reaktionsträge, weshalb sie damals als ungefährlich galten. Daran, dass solch unreaktive Moleküle in der Luft auch nicht abgebaut werden können und so lange erhalten bleiben, bis sie den beschwerlichen Weg in die Stratosphäre meistern, hat damals noch niemand gedacht.
So geraten die FCKW in der Stratosphäre an UV-C-Strahlung, die selbst Moleküle spaltet, die sonst nicht reagieren, wie zum Beispiel:
Es entstehen also reichlich zusätzliche Cl•-Radikale, die den Ozonabbau beschleunigen. Und so weit gingen die Voraussagen der Wissenschaftler schon in den 1970er Jahren. Nur hat damals niemand darauf gehört. Erst als 1985 bekannt wurde, dass die minimale Dicke der Ozonschicht über der Antarktis, die jeden Süd-Frühling durchlaufen wird, innerhalb von drei Jahrzehnten von rund 300 DU auf unter 100 DU abgesunken war, war das Erschrecken gross. Denn mit einem so schnellen Abbau hatten nicht einmal die Wissenschaftler gerechnet.
So hat die Weltpolitik für einmal phänomenal schnell reagiert und schon 1987 die Verwendung von FCKW mit der Unterzeichnung des Montrealer Protokolls eingeschränkt und in der Londoner Konferenz 1990 bis zum Jahr 2000 ganz verboten. In Folge dessen wird das Ozonloch wieder kleiner – Simulationen sagen voraus, dass die Ozonschicht sich wieder ganz erholen wird, wenn wir uns weiterhin beflissen an die genannten Protokolle halten.
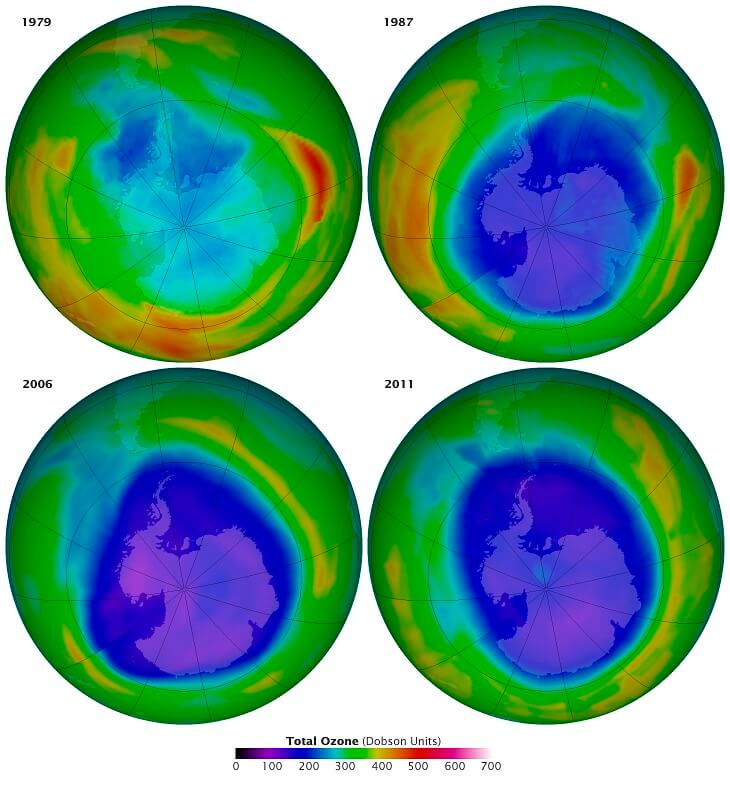
Das Ozonloch im Laufe der letzten Jahrzehnte: vor seiner „Entdeckung“ (peinlich für die NASA: sie hatten es bereits registriert und bis 1985 für fehlerhafte Messwerte gehalten), zum Zeitpunkt des Montrealer Protokolls, bei seiner maximalen Ausdehnung 2006 und sichtlich kleiner im Jahre 2011 (Bildquelle: NASA)
Damit hat das Schreckgespenst Ozonloch, das erst durch das Zusammenwirken des kalten Polarwirbels mit den von Menschenhand freigesetzten FCKW entstanden ist, uns vor dem eigentlichen Problem bewahrt: Dem weltweiten und längerfristigen Abbau der Ozonschicht durch solche Stoffe.
Gibt es weitere Gefahren für die Ozonschicht?
Nun rückt allerdings eine zweite Einflussmöglichkeit auf die Ozonschicht zunehmend in den Fokus der Öffentlichkeit, nämlich die Freisetzung von Lachgas (N2O). Lachgas entsteht in grösseren Mengen beim Einsatz von stickstoffhaltigen Düngern oder als Abgas von Kraftfahrzeugen und Kraftwerken. Es kann mit atomarem Sauerstoff zu Stickstoffmonoxid reagieren, welches sich dann am Ozonabbau beteiligen kann:
Im Vergleich zur Wirkung der FCKW ist die ozonabbauende Wirkung von Lachgas aber verschwindend (man erwartet einen Ausdünnung der Ozonschicht von 2,6DU bis Ende des Jahrhunderts durch Lachgas). Viel bedeutender ist, dass Lachgas ein hochwirksames Treibhausgas ist…aber das ist eine andere Geschichte.
Was Ozon noch kann
Ozon in unmittelbarer Nähe ist nicht nur für uns giftig (siehe Teil 1 dieses Artikels), sondern es tötet auch Keime, wirkt entzündungshemmend und sogar durchblutungsfördernd. So findet es vielfältigen Einsatz in der Medizin. Zahnärzte nutzen Ozon zur Karies-Frühbehandlung oder zum Desinfizieren ausgeräumter Wurzelkanäle sowie – in Wasser gelöst – als desinfizierende Mundspülung. In der Komplementärmedizin werden Wunden und andere Hautschäden zur Desinfektion mit Ozon „begast“ (in einem Beutel oder unter einer Glocke, damit das Gas dort bleibt, wo es hin soll und nicht eingeatmet wird).
Ausserdem wird Ozon im eigenen, zuvor entnommenen Blut des Patienten gelöst sogar als Infusion gegeben oder gespritzt um Durchblutungsstörungen und ihre Folgen zu behandeln. Allerdings haben auch andere Gase ebenso durchblutungsfördernde Wirkung. Weitere heilsame Wirkungen des Ozons gelten zudem als nicht wissenschaftlich belegt.
Zu guter Letzt findet Ozon oft als Ersatz für das giftigere Chlor-Gas (Cl2) Verwendung. „Chlorfrei gebleichte“ oder anderweitig „chlorfrei“ behandelte Produkte, von Papier bis hin zu keimfrei aufbereitetem Trinkwasser sind meist mit Ozon behandelt – denn Chlor wirkt ähnlich wie Ozon oxidierend. Aber das ist eine andere Geschichte.
Fazit: Ozon ist ein Gas mit vielen Gesichtern
Ozon in der Stratosphäre bewahrt uns vor Schaden durch UV-Strahlung, während Ozon in unserer direkten Umgebung giftig für viele Lebewesen ist. Während wir unsere Ozonschicht hüten und mit dem vielgesichtigen Gas gezielt Keime töten, haben wir viel daran zu tun, unsere Atemluft möglichst frei von überschüssigem Ozon zu halten.
Und wo ist dir zuletzt Ozon begegnet?
[1] S.Brönnimann (2002): Ozon in der Atmosphäre. Verlag Paul Haupt, Bern, Stuttgart, Wien.