Der Frühling kommt unaufhaltsam, und mit ihm rücken die Ostertage immer näher. Nach dem grauen Winter gibt es wohl kaum jemanden, der sich nicht nach dieser hellen Zeit voller Farben sehnt: Sonne, Frühlingsblumen, bunte Eier… doch bis es soweit ist, und wir uns an den Farben freuen können, steht noch Arbeit an. Im Supermarkt gibt es reichlich Hilfsmittel im Angebot, unter anderem eine breite Palette von Färbemitteln für die Eier. Das verspricht Mal- und Bastelspass für Gross und Klein!
Als ich mir die Packungen – bei den beiden bekanntesten Schweizer Grossverteilern von einem deutschen Hersteller – genauer ansah, war jedoch zunächst einmal meine Chemiker-Neugier geweckt: Das Verzeichnis der Inhaltsstoffe bestand durchweg aus einer umfangreichen Liste von E-Nummern. Nun, die sind für sich erst einmal nichts schlimmes, sind doch einer ganzen Reihe nützlicher und gesunder Substanzen – beispielsweise vielen Vitaminen – E-Nummern zugeordnet, die als Kurzschreibweise die gesetzliche Kennzeichnungspflicht auf kleinstmöglichem Raum erfüllen. Hier jedoch beschlich mich ein Verdacht. Und da ich kein wandelndes E-Nummern-Lexikon bin, habe ich die Zahlensammlung rasch ins Smartphone abgetippt, um sie später in Ruhe nachzuschlagen.
Und ich sollte recht behalten: Die Liste hält eine wahre Fülle synthetischer Farbstoffe bereit, die auf den ersten Blick klangvolle, optimistische Namen haben:
- E 104 Chinolingelb
- E 110 Gelborange S
- E 122 Azorubin
- E 124 Cochenillerot A
- E 131 Patentblau V
- E 132 Indigotin
- E 133 Brilliantblau FCF
- E 142 Grün S
- E 151 Brilliantschwarz BN
All diese Stoffe sind organische Verbindungen, und die Stoffklassen, welchen sie angehören, sind mir (und wohl jedem anderen Chemiker) aus dem Studium wohlbekannt: Zu den sogenannten Triphenylmethan-Farbstoffen zählen viele bekannte Indikatoren, zum Beispiel das Phenolphthalein, aber auch Patentblau V, Brilliantblau FCF und Grün S (E 131, 133 und 142). Einen Vertreter der sogenannten Azofarbstoffe, zu welchen E 110, E 122, E124, E 132 und E 151 zählen, habe ich einst sogar selbst im Labor synthetisiert. Dabei sind mir als sicherheitsbewusster Chemikerin neben den strahlenden Farben besonders diese Eigenschaften dieser Stoffe in Erinnerung geblieben: giftig, potentiell krebserzeugend, überaus wasserlöslich und damit im Handumdrehen überall verteilt. Und sowas sollte für Lebensmittel zugelassen sein?
Aber welche organischen Verbindungen sind eigentlich farbig? Kann man Farbstoffe nach Wunsch „erfinden“? Und wie gesundheitsschädlich sind die synthetischen Ostereier-Farben wirklich? Sollte man sie meiden?
Welche organischen Moleküle sind farbig?
Unser Eindruck von Farbigkeit organischer Stoffe entsteht genauso wie bei allen anderen Stoffen auch. In „Farben, Licht und Glanz – Wie die Welt uns bunt erscheint“ habe ich bereits vom Aufbau der Elektronenhülle von Atomen erzählt, innerhalb welcher Elektronen von Etage zu Etage „umziehen“ können, indem sie Licht mit einer genau passenden Wellenlänge schlucken. Was dann vom einstmals weiss erscheinenden Gemisch aller Licht-Wellenlängen übrig bleibt, bestimmt die Farbe, die wir sehen – nämlich die Komplementärfarbe zur geschluckten Wellenlänge.
Farbig sind also solche Teilchen, in deren Elektronenhülle es Abstände zwischen Energieniveaus („Etagen“) gibt, welche durch das Schlucken von Licht-Wellenlängen im sichtbaren Bereich überbrückt werden können. In einem Molekül, in welchem die Atome über Elektronenpaarbindungen miteinander verbunden sind, teilen die Atome gemeinsame Energieniveaus, welche ihrerseits in „Wohneinheiten“, sogenannte Orbitale, für je zwei Elektronen unterteilt sind. Und (nicht nur) für organische Moleküle gilt die Faustregel:
Die Abstände zwischen Energieniveaus liegen dann im sichtbaren Bereich, wenn sich viele Elektronen „Wohngemeinschaften“, also miteinander verbundene „Wohneinheiten“ bzw. Orbitale teilen – in der Chemikersprache gesagt: wenn die Elektronen „delokalisiert“ sind.
In den üblichen Einfach-Elektronenpaarbindungen bleibt allerdings jedes Elektronenpaar unter sich. Erst wenn Doppelbindungen vorkommen, wird die Sache interessant. Denn eine Doppelbindung kann man sich dergestalt vorstellen, dass eine zweite Bindung eine Einfachbindung zwischen zwei Atomen ähnlich einem Schlauch umgibt – und an beiden Enden ein gutes Stück darüber hinaus ragt. Wenn nun zwei Doppelbindungen auftreten, welche nur durch eine Einfachbindung voneinander getrennt sind, können die „überstehenden“ Enden der beiden Doppelbindungen miteinander verschmelzen, sodass die darin enthaltenen vier Elektronen sich entlang aller vier beteiligten Atome bewegen können – also delokalisiert sind.
Sich abwechselnde Doppel- und Einfachbindungen entsprechen also einer für farbige Stoffe massgeblichen atomaren „Wohngemeinschaft“.
Das bedeutet: Es lässt sich an der Lewis- oder Strichformel eines organischen Stoffes abschätzen, inwieweit dieser farbig ist! Dabei gilt grundsätzlich: Je mehr sich abwechselnde Doppel- und Einfach-Bindungen ein Molekül enthält, d.h. je weiter die enthaltenen Elektronen delokalisiert sind, desto farbiger ist der entsprechende Stoff.
Darüber hinaus kann die Farbe eines Stoffes weiter intensiviert werden, wenn das Molekül bestimmte Atomgruppen enthält, die an und für sich schon farbig sind. Eine solche „Chromophor“ genannte Atomgruppe ist die aus zwei Stickstoffatomen bestehende Azogruppe, -N=N-, welche den Azo-Farbstoffen ihren Namen gegeben hat.
Wie organische Farbstoffe aufgebaut sind
In einem typischen Farbstoffmolekül sind eine oder mehrere chromophore Gruppen in ein System aus sich abwechselnden Doppel- und Einfachbindungen eingegliedert. Nicht selten sind aromatische Ringe – meist sechseckige „Benzol-Ringe“ aus sechs Kohlenstoff-Atomen – Teil dieses Systems, da diese in ganz besonderer Weise delokalisierte Elektronen aufweisen. Da eben diese Besonderheit die aromatischen Ringe jedoch in vielerlei Hinsicht unreaktiv macht, enthalten gute Farbstoff-Moleküle überdies besonders reaktionsfreudige Atomgruppen, die mit anderen Stoffen feste Bindungen eingehen und dem Farbstoff so erlauben, am zu färbenden Material – zum Beispiel Textilfasern oder Eierschalen – möglichst waschecht zu haften. Solche Gruppen werden „Auxochrome“ – Farbhelfer – genannt.
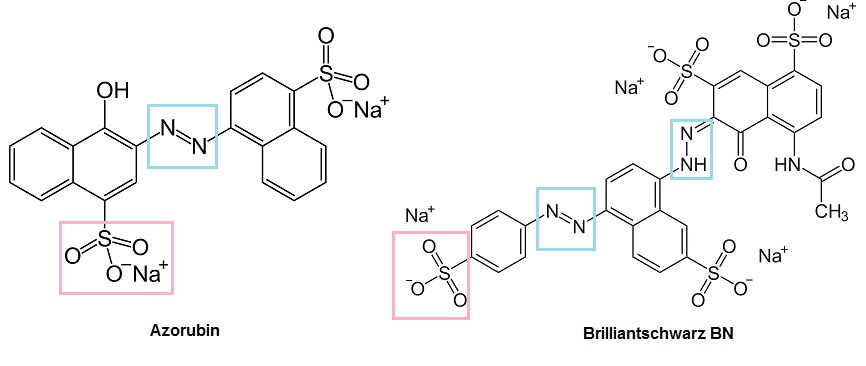
Azorubin (linke Formel) ist ein typischer Azofarbstoff, dessen Azogruppe (hellblau gerahmt) zwischen zwei aromatischen Ringen zu finden ist. Doppel- und Einfachbindungen wechseln sich in diesem System also über alle vier Ringe und die Azogruppe hinweg ab. Am Rand des Moleküls finden sich als Auxochrome mehrere Sulfonsäure-Gruppen (rosa gerahmt, dargestellt als Natrium-Salz). Eine Sulfonsäure-Gruppe ist nichts anderes als ein Teil eines Schwefelsäure-Moleküls, welcher mit dem Kohlenstoff-Gerüst des Farbstoffs verknüpft ist. Dementsprechend können diese Gruppen ähnlich wie Schwefelsäure sowohl Ionen- bzw. Säure-Base-Reaktionen eingehen, als auch Ester und andere feste Verknüpfungen über Elektronenpaar-Bindungen bilden. Sulfonsäuren, besser noch ihre Salze, sind also sowohl wasserlöslich als auch in der Lage, feste Bindungen einzugehen.
Die rechte Formel lässt überdies die Bedeutung der Chromophore erahnen: Brilliantschwarz – Schwarz als intensivste „Farbe“ ergibt sich, wenn sämtliche sichtbaren Lichtwellen geschluckt werden – enthält statt einer Azo-Gruppe gleich zwei – und der Stoff ist nicht bloss intensiv farbig, sondern schwarz.
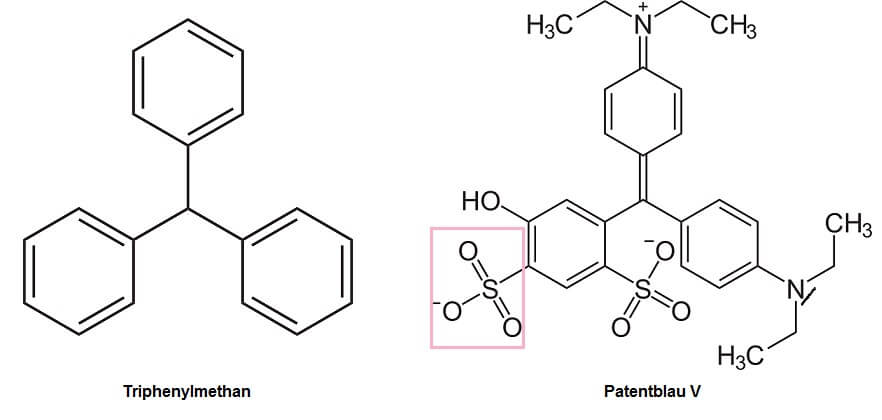
Auch Triphenylmethan-Farbstoffe enthalten aromatische Ringe – wenn solch ein Ring an etwas anderes gebunden ist, nennen die Chemiker ihn „Phenyl-Gruppe“ – aber keine weiteren chromophoren Gruppen. Das Grundgerüst dieser Farbstoffe entspricht also einem Methanmolekül (CH4), in welchem drei der Wasserstoff-Atome durch Phenyl-Gruppen ersetzt sind (links im Bild die Strukturformel für „Triphenylmethan“, welches diesen Farbstoffen ihren Namen gibt). Auch im rechts gezeigten Patentblau V finden sich Sulfonsäuregruppen als Auxochrome.
Die Eigenschaften solcher Farbstoffe lassen sich nicht nur auf diese Weise aus den Strukturformeln ablesen. Die Regeln der Chemie zur Farberscheinung und zu anderen Eigenschaften sind gar so präzise, dass Chemiker die Farbe eines Moleküls ausrechnen – bzw. sich ein Molekül mit der gewünschten Farbe und weiteren Eigenschaften ausdenken können! Da liegt es nahe, für Ostereier und andere Lebensmittel Farbstoffe zu designen, die sowohl die gewünschten Farben haben, als auch unschädlich für den menschlichen Körper sind.
Aber wie gesundheits(un)schädlich sind diese Designer-Farbstoffe wirklich?
Aufnahme und Anreicherung von Lebensmittelfarbstoffen
Der ideale Lebensmittelfarbstoff wird auf seinem Weg durch den Verdauungstrakt gar nicht erst vom Körper aufgenommen und unverändert wieder ausgeschieden. An dieses Ideal kommen die Triphenylmethan-Farbstoffe unter den Ostereierfarben nahe heran: Sie werden weder vom Körper aufgenommen, noch im Verdauungstrakt gespalten oder anderweitig verändert. Die auxochromen Gruppen erweisen sich in diesem Zusammenhang wiederum als nützlich: Aufgrund der guten Wasserlöslichkeit der Moleküle besteht überdies kaum Gefahr, dass diese sich – über längere Zeit aufgenommen – irgendwo im Körper anreichern.
Etwas anders sieht es bei den Azofarbstoffen aus, da der menschliche Organismus in der Lage ist, die Azo-Gruppe solcher Moleküle zu spalten. Somit müssen also nicht nur die Moleküle selbst, sondern auch die Bruchstücke unbedenklich sein. Und unter den Bruchstücken von Azo-Farbstoffen sind aromatische Amine, also solche, die neben einem Benzol-Ring auch eine zusätzliche Stickstoff-Gruppe enthalten, für eine krebserzeugende Wirkung berüchtigt. Jener Azo-Farbstoff, den ich einst im Labor synthetisiert habe, mag ein solches Fragment enthalten haben. Die Lebensmittelfarbstoffe enthalten derlei jedoch aus gutem Grund nicht. Ihre Bruchstücke sind harmlos und werden problemlos wieder ausgeschieden.
Allergische Reaktionen
Nichts desto trotz sind alle „Designer-Stoffe“, zu welchen die synthetischen Lebensmittel-Farbstoffe zählen, aus Sicht des menschlichen Körpers „Fremdstoffe“, welche pseudoallergische Reaktionen auslösen können. Dabei handelt es sich um unspezifische Abwehrreaktionen auf die Gegenwart eines Fremdstoffs: Wie bei einer Allergie können Entzündungssymptome auftreten, von Hautauschlag (Neurodermitis) bis hin zu Asthma. Das Ausmass dieser Symptome hängt dabei von der jeweiligen Dosis des Auslösers ab. Das heisst, ausreichend geringe Mengen des Auslösers werden mitunter gar keine spürbare allergische Reaktion auslösen.
Im Unterschied dazu werden bei einer „echten“ Allergie Antikörper gegen den Auslöser (das „Allergen“) gebildet, welche das Immunsystem in Gang setzen und so die Abwehrreaktion auslösen. Da dieser Weg der Abwehr nach dem Alles-oder-Nichts-Prinzip funktioniert, können schon kleine Mengen eines Allergens eine heftige Reaktion nach sich ziehen.
Pseudoallergische Reaktionen auf Farbstoffe können also durch die Verwendung ausreichend kleiner Mengen weitgehend vermieden werden. Allerdings ist z.B. bei Personen, die auch auf den Aspirin-Wirkstoff Acetylsalicylsäure pseudoallergisch reagieren, häufig eine besondere Empfindlichkeit gegenüber Lebensmittelfarbstoffen beobachtet worden.
Hyperaktivität und Konzentrationsstörungen
Seit 2007 ist eine Studie populär, die einen Zusammenhang zwischen der Aufnahme von Lebensmittelfarben aus der Gruppe der Azo-Farbstoffe und Hyperaktivität bzw. Konzentrationsstörungen von Kindern festgestellt haben will. Nach dem Arbeitsort ihrer Autoren wird diese Studie kurz als „Southhampton-Studie“ bezeichnet. Sie führte dazu, dass in der EU in jüngster Zeit eine Kennzeichnungspflicht für Lebensmittel mit Azo-Farbstoffen eingeführt worden ist: Solche Produkte müssen neuerdings eine Aufschrift „kann Aktivität und Aufmerksamkeit bei Kindern beeinträchtigen“ tragen. Ostereier-Farben sind übrigens davon ausgenommen – die bunten Eierschalen werden schliesslich nicht verzehrt, heisst es – weshalb ich auf den Verpackungen „meines“ deutschen Herstellers auch keinen solchen Hinweis gefunden habe.
Das Schweizer Bundesamt für Lebensmittelsicherheit und Veterinärwesen (BLV) bezeichnet die Southampton-Studie allerdings in vielen Punkten als unwissenschaftlich (die Kritikpunkte reichen von der Erhebung von Daten durch ungeschultes, nicht neutrales Personal bis zu unklaren Messgrössen und Untersuchungsgegenständen) und die Schlussfolgerungen daraus als widerlegt. Aus diesem Grund, so das BLV, gibt es in der Schweiz keine entsprechende Kennzeichnungspflicht.
Das Verhalten von Kindern bzw. Schülern ist ebenfalls Forschungsgegenstand in der Erziehungswissenschaft und Didaktik. So habe ich aus meiner Literatur aus der Lehrerausbildung den Eindruck gewonnen, dass wohl kaum ein Forschungsgegenstand schwieriger zu erfassen ist, als Einflüsse von Massnahmen – seien es Chemikalien oder Unterrichtsmethoden – auf das Verhalten von Kindern. Deshalb erfordern der Entwurf, die Durchführung und nicht zuletzt die Auswertung derartiger Studien in meinen Augen allerhöchste Sorgfalt und Vorsicht, sodass ich dazu neige, dem BLV und seinen Kritikpunkten in Sachen Lebensmittelfarbstoffen bei zu pflichten.
Insbesondere einen Zusammenhang zwischen Lebensmittelfarbstoffen und dem als ADHS (Aufmerksamkeits-Defizit-/Hyperaktivitäts-Syndrom) bezeichneten Syndrom, welches gerne in diesem Kontext genannt wird, kann ich nicht nachvollziehen. Viel einleuchtender erscheint mir da, dass pseudoallergischer Juckreiz und ähnliche Reaktionen Kinder unruhig und unaufmerksam werden lassen.
Welche Alternativen gibt es zu synthetischen Ostereier-Farben?
Es liegt mir fern, die synthetischen Ostereier-Farben als „gut“ oder „schlecht“ abzustempeln. Vielmehr möchte ich Hintergrundwissen liefern, anhand dessen jeder selbst entscheiden mag, was für ihn, sie oder seine/ihre Kinder das Beste ist. Auf diesem Grundsatz – jeder hat das Recht selbst zu entscheiden, was er verwendet oder gar zu sich nimmt – basiert in meinen Augen auch unser Lebensmittelrecht, sowohl in der Schweiz als auch in der EU, welches die Auflistung von Inhaltsstoffen auf der Verpackung von Lebensmitteln und anderen Waren vorschreibt.
Nach allem, was ich nun gelesen habe, sehe ich keinen Grund zu der Annahme, dass synthetische Ostereier-Farben per se gefährlich sein bzw. unweigerlich krank machen sollten. Ganz und gar unbedenklich sind sie deshalb aber noch lange nicht – nicht zuletzt, weil jeder Körper anders auf einen Stoff reagieren kann. Das gilt übrigens für viele sogenannte Naturstoffe ebenso wie für synthetische Verbindungen, denn auch die meisten Naturstoffe sind aus Sicht des menschlichen Körpers letztlich Fremdstoffe. Und Allergien – auch „echte“ – auf „ganz normale“ Lebensmittelbestandteile sind uns zu Genüge bekannt.
Wer sich schliesslich für die Naturstoff-Variante für seine Ostereier entscheidet, kann eine ganze Reihe wunderschöner Naturfarbstoffe in Lebensmittel-Pflanzen wie Rote Bete (in der Schweiz „Rande“) (rot), Curcuma (gelb), Spinat (grün), Zwiebelschalen (braungelb) oder Rotkohl bzw. Blaukraut (blauviolett) finden.
Eine tolle Anleitung zum Färben mit diesen Farbstoffen und Verzieren der Eier mit Essig-Mustern gibt es auf der Website von GEOLino. Und die dort gezeigten Eier sind fast so strahlend bunt wie die synthetischen Designerfarben – der wärmeren Farbtöne wegen finde ich sie sogar schöner als jene, die auf den Verpackungen der synthetischen Färbemittel abgebildet waren!
Ob nun synthetisch oder mit Naturstoff-Eiern: Ich wünsche euch frohe, farbenreiche Ostern!
Und womit färbt ihr eure Ostereier?









































