Ein verregneter Frühling ist – wohl oder übel – Zeit für Schlechtwetterprogramm. Aber was tun? Experimentieren oder Haushalt? Warum nicht beides miteinander? Ich habe einen genialen Hack für euer Kupfer-Geschirr – mit Experiment für eure Kinder dazu!
Habt ihr einen Kupfertopf? Armaturen oder andere Gegenstände aus Messing? Und die sind mal wieder ziemlich angelaufen und sollten dringend geputzt werden? Dann legt los – und zwar ganz ohne kommerzielle Reinigungspaste. Denn was ihr braucht, findet ihr mit Sicherheit in der Küche.
Kupfer und Messing reinigen: Ihr braucht dazu
- Angelaufenen Kupfertopf o.Ä.
- Papiertücher (könnt ihr einfach entsorgen, da ihr sie nicht auswaschen müsst!)
- Ggfs. Putzhandschuhe
- Haushaltsessig
- Kochsalz (Speisesalz, NaCl)
Und für ein simples, aber atemberaubendes Experiment für die Nachwuchs-Forscher das Ganze im Kleinformat…
Experiment: Kupfermünzen reinigen: Ihr braucht dazu
- Kupfermünzen (nachweislich funktionieren Euro-Cents, britische Pennys und US-Cents, Münzen mit messinggoldener Oberfläche wie das Schweizer Füüferli oder tschechische 20 Kronen bringen kein gutes Ergebnis)
- Haushaltsessig
- Kochsalz
- leeres Glas (z.B. Gewürzglas, praktisch mit gewölbtem Boden)
- ggfs. Schutzbrille und Kittel für die Nachwuchs-Forscher
Haushaltsessig und andere Säuren wirken ätzend! Essigsäure ist jedoch eine schwache Säure, die unserer Haut dank deren Säureschutz nicht gleich Schaden zufügt. Deshalb trage ich beim Umgang mit solch kleinen Mengen keine Handschuhe.
Wenn ihr Essig auf die Haut bekommt, spült ihn einfach gründlich mit Wasser ab. Sollte euch ein Spritzer in die Augen geraten (die Schutzbrille sollte das verhindern!), spült die Augen sehr gründlich mit fliessendem Wasser aus (10 Minuten lang heisst es im Labor!) und geht bei bleibenden Beschwerden zur Sicherheit zum Augenarzt.
Wenn Spritzer auf die Kleidung kommen, zieht sie aus und wascht sie ebenfalls sofort sehr gründlich aus. Wenn die Säure die Textilien angreift, können sonst später beim Waschen in der Maschine noch Löcher entstehen!
So geht’s
Experiment
Gebt ca. 1 cm hoch Haushaltsessig ins Glas, dann eine angelaufene Kupfermünze hinein. Schliesslich gebt ihr reichlich – etwa einen Teelöffel – Kochsalz hinzu.

Kupfertopf reinigen
Gebt einen Schuss Essig auf euren Lappen und streut Kochsalz auf den nassen Fleck. Nicht damit sparen! Dann poliert euren Kupfertopf oder Messinggegenstand mit dem Gemisch. Sobald der Topf blank ist, könnt ihr ihn mit einer kleinen Menge Speiseöl einreiben, damit er nicht sogleich wieder anläuft.
Was ihr beobachten könnt
Beim Experimentieren
Die dunkel angelaufene Kupfermünze wird innerhalb von Sekunden hell! Fischt die Münze aus dem Glas, sobald sie hell genug ist (eine Gabel ist dabei sehr hilfreich) und spült sie kurz mit Wasser ab.

Beim Reinigen des Kupfertopfes oder Messinggegenstandes
Das Kupfer oder Messing wird sofort blank, wie beim Putzen mit einer kommerziellen Reinigungspaste!
Entsorgung
Kupferionen sind giftig für Wasserorganismen und andere Kleinstlebewesen. Deshalb gehören sie grundsätzlich als Sondermüll entsorgt. Die winzigen Mengen, welche beim Experimentieren mit Münzen entstehen, könnt ihr aber mit dem Essig-und-Salz-Gemisch in den Abfluss entsorgen.
Die Papiertücher, mit welchen ihr Kupfertöpfe und Messing putzt, könnt ihr in den Hausmüll geben oder – wenn ihr die Kupfergeschirr-Komplettausstattung eurer Profi-Küche poliert und so grössere Mengen erzeugt habt 😉 – trocknen lassen und zur Sonderabfall-Sammelstelle bringen.
Was passiert da?
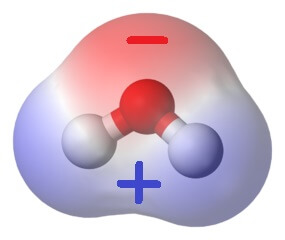
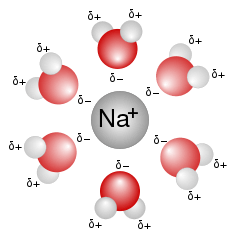
Die dunkle Farbe angelaufenen Kupfers ist ein Belag aus Kupferoxiden, hauptsächlich aus schwarzem Kupfer(II)oxid (CuO). Dieses Salz besteht aus Cu2+– und O2- -Ionen. Cu2+-Ionen können sich in Wasser lösen, wobei sie von Wassermolekülen umgeben werden.
Dabei nehmen sechs Wassermoleküle der innersten Wasserschicht um ein Cu2+-Ion ganz bestimmte, geometrische Positionen ein: Die Ecken eines lang gezogenen Oktaeders.
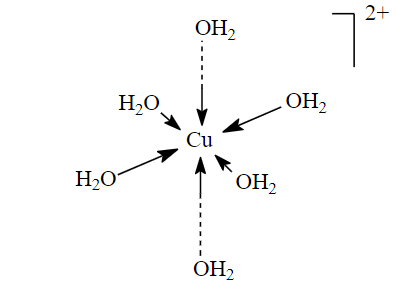
Wie sie dazu kommen? Ein Cu2+-Ion hat relativ wenig Elektronen (immerhin zwei weniger, als zum Ausgleich seiner Kernladung nötig wären). Wassermoleküle hingegen haben – zumindest am Sauerstoff-Ende – ziemlich viele davon, und zwar ganze zwei äussere Elektronenpaare, die für keine chemische Bindung innerhalb des Moleküls gebraucht werden. So können Wassermoleküle eines dieser nichtbindenden Elektronenpaare einem Cu2+-Ion „ausleihen“.
Damit entsteht eine chemische Bindung zwischen Wasser und Kupfer-Ion, die von den Chemikern „koordinative Bindung“ oder „Komplexbindung“ genannt wird. „Komplex“ ist daran allerdings nur, dass ein Bindungspartner dem anderen ein Elekronenpaar ausleiht, anstatt dass wie bei der kovalenten oder Atombindung jeder Partner ein Elektron dazu beisteuert.
Komplexbildungsreaktionen sind Gleichgewichtsreaktionen
Cu2+-Ionen sind nun damit zufrieden, von sechs geliehenen Elektronenpaaren jeweils ein Bisschen zu haben. Allerdings lange nicht so zufrieden wie damit, einen Platz in einem CuO-Kristallgitter zu haben.
Stets kehren Cu2+-Ionen aus der Lösung in das Kristallgitter zurück: Die [Cu(H2O)6]2+ – Komplexe befinden sich stets mit dem Kupfer-Ionen im Kristallgitter in einem chemischem Gleichgewicht (Le Chatelier erklärt euch das Gleichgewicht hier auf dem Flughafen genauer).
Dieses Gleichgewicht liegt in Wasser allerdings ganz weit auf der Seite des Salzkristalls, es sind nur ganz wenige [Cu(H2O)6]2+ -Komplexe in Lösung.
Kochsalz übt einen Zwang aus
Gibt man nun reichlich Kochsalz (NaCl) in das Wasser, löst sich dessen Gitter auf: Na+– und Cl–-Ionen gehen einzeln ins Wasser über . Die Cl–-Ionen können ebenfalls Komplexe mit Kupfer bilden: Sie können Wassermoleküle im [Cu(H2O)6]2+ ersetzen, sodass Komplexe wie [Cu(H2O)5Cl]+ entstehen:
Die Art Reaktion nennen die Chemiker „Ligandenaustauschreaktion“: Die Teilchen, welche dem Kupfer-Ion (dem „Kern“) im Zentrum des Komplexes die Elektronenpaare leihen, heissen nämlich „Liganden“ (von lateinisch ligare = binden).
Durch solche Reaktionen können bis zu vier Wassermoleküle ausgetauscht werden. Die zwei verbleibenden Wassermoleküle bilden nun die Spitzen des langgezogenen Oktaeders.
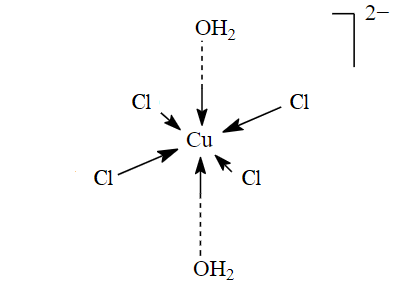
All diese Komplexe stehen miteinander im Gleichgewicht. Das schiere Überangebot an Cl–-Ionen allein sorgt dafür, dass diese Gleichgewichte jeweils auf die Seite mit mehr Chlorid im Komplex gedrängt werden. So einem Zwang wie dem Cl–-Überschuss will das ganze System nämlich ausweichen.
Der Knackpunkt dabei: Durch die Entstehung der Komplexe mit Chlorid wird dem Gleichgewicht zwischen CuO und gelösten Kupferionen das [Cu(H2O)6]2+ entzogen! Laut dem Prinzip von Le Chatelier strebt das Gleichgewicht danach, auh diesen Verlust auszugleichen: Der Verlust der Kupferionen mit reiner Wasserhülle zieht das Gleichgewicht förmlich auf die Seite des gelösten [Cu(H2O)6]2+. So geht in der Anwesenheit von reichlich Cl– mehr Cu2+ aus dem CuO in Lösung.
Und was tut der Essig dabei?
Mit Kochsalz und blossem Wasser funktionieren diese Ligandenaustauschreaktionen kaum: Das Kupferoxid bleibt an der Oberfläche haften – der Kupfertopf bleibt dunkel.
So lautete meine erste Vermutung Die Säure (Haushaltsessig ist nichts anderes als Essigsäure gelöst in Wasser) fördert irgendwie die Entstehung der chloridhaltigen Komplexe. Befriedigend war diese Erklärung aber lange nicht.
Deshalb habe ich meine Chemiker-Gedanken weiter gesponnen und bin zu folgender Erklärung gelangt:
Wenn Cu2+-Ionen aus dem CuO in Lösung gehen, müssen die O2--Ionen aus dem Gitter auch irgendwo hin. Allerdings können die nicht einfach von Wassermolekülen umgeben existieren. Stattdessen reagieren sie mit dem Wasser zu OH–-Ionen:
Auch zwischen diesen Reaktionspartnern besteht ein Gleichgewicht, das nicht all zu weit auf der Seite der OH–-Ionen liegen mag. Ist im Wasser allerdings eine Säure (ein Stoff, der mit Wasser H3O+-Ionen erzeugen kann) vorhanden, reagieren die OH–-Ionen allerdings gleich wieder zu Wasser:
Diese Gleichgewichtsreaktion nennen die Chemiker „Neutralisation“! Es liegt nämlich recht weit auf der Wasser-Seite, sodass eine Säure wie H3O+ und eine Base wie OH– ganz von selbst miteinander reagieren. Durch den „Verbrauch“ von OH–-Ionen durch die Neutralisation wird wiederum das Gleichgewicht zwischen O2- im CuO-Gitter und den OH–-Ionen in Lösung auf die OH–-Seite gezogen.
Zum besseren Überblick habe ich die wichtigsten Gleichgewichte und ihre Abhängigkeiten voneinander noch einmal zusammengefasst:
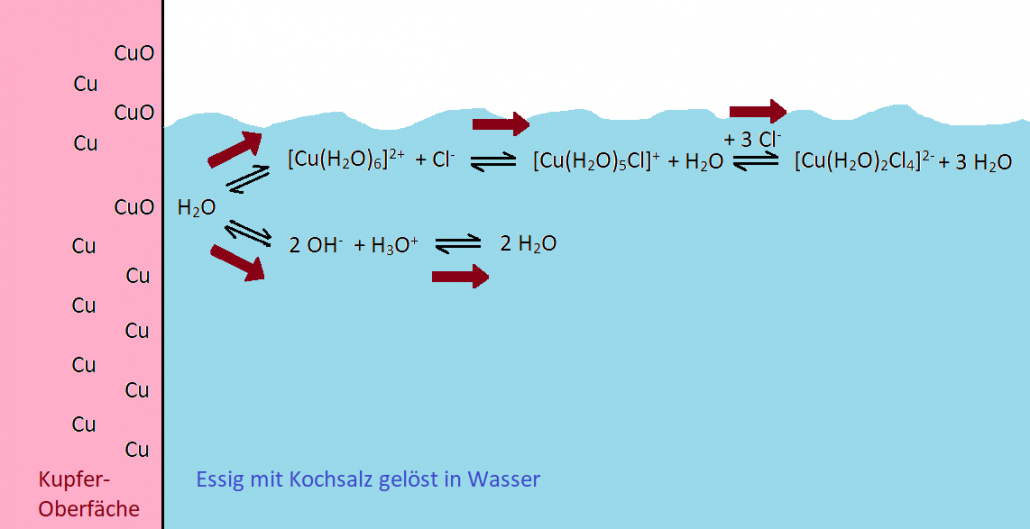
Wenn meine Erklärung zutrifft, müsste das Ganze auch mit Kochsalz in anderen Säuren funktionieren. Ich habe es ausprobiert: Kochsalz in Zitronensäure zeigt beim Polieren die gleiche Wirkung.
Aber Kupfer(II)-Komplexe sind doch farbig?
Die Chemie-Erfahreneren unter euch wissen vielleicht, dass die Komplexe mit Cu2+-Ionen eigentlich sehr farbig sind: [Cu(H2O)6]2+ ist zum Beispiel cyanblau, während die chloridhaltigen Komplexe zunehmend grün sind. Warum sieht man dann beim Reinigen der Münzen die Farben nicht?
Ich gehe davon aus, dass diese Komplexe insgesamt in so kleiner Menge entstehen, dass uns die äusserst blasse blau-grüne Färbung schlichtweg nicht auffällt.
Wie verträglich ist die Reinigung mit Essig und Kochsalz für die Kupfer-oberfläche?
Durch die Ligandenaustauschreaktionen wird das Kupfer-Metall nicht wieder hergestellt. Stattdessen wird bereits oxidiertes Kupfer in Wasser gelöst, sodass es abgewaschen werden kann. Wie bei allen anderen mir bekannten Mitteln zur Entfernung von Korrosionsspuren würde auch dieses bei wiederholtem Putzen irgendwann das Metall „aufbrauchen“.
Im praktischen Gebrauch bei der Reinigung von Kupfertöpfen und ähnlichen Gegenständen fällt diese Verlust jedoch nicht ins Gewicht. Zudem gehe ich davon aus, dass kommerzielle Reinigungspasten nach dem gleichen Prinzip funktionieren. Ihr könnt also getrost eure Kupfertöpfe mit Essig und Kochsalz polieren.
Und Messingoberflächen?
Messing ist eine Legierung – also ein Gemisch – aus den Metallen Kupfer und Zink. Auch in Messing sind also Kupferatome enthalten, die, wenn sie zu CuO oxidiert werden, dem Metall ein dunkles, stumpfes Aussehen geben. Damit sollte sich dieses Problem mit Hilfe der selben Reaktionen beheben lassen.
Tatsächlich habe ich auch den Messinggriff meines Kupfertopfes problemlos mit Essig und Kochsalz polieren können. Lasst dabei jedoch die Mischung nicht unnötig lange einwirken, sondern spült sie gleich nach dem Putzen ab!
Beim Experimentieren mit Messingmünzen habe ich nämlich festgestellt, dass die Mischung Zink oder/und andere Bestandteile der Legierung aus der Oberfläche herauslösen kann. Die Folge: Die ehemals messinggoldene Oberfläche wird zwar blank, aber rot wie Kupfer!
Zink ist nämlich ein ziemlich unedles Metall, sodass es von der Säure angegriffen werden könnte. Die Säurekorrosion habe ich hier zur Rostparade oder zum Anhören in der neuen Folge des Proton-Podcasts (erscheint in Kürze) erklärt.
Bild: Tschechische 20-Kronen-Münze rot verfärbt
Was euch die Verwendung dieses Hausmittels bringt
Wie bereits erwähnt vermute ich, dass im Handel erhältliche Reinigungspaste für Kupfer und Messing auf die gleiche Weise funktioniert wie das Gemisch aus Säure und Kochsalz – nämlich mit Chemie. Welchen Vorteil habt ihr dann aber von diesem Hausmittel?
Wie ihr seht: Ohne Chemie geht nichts im Haushalt. Anders als bei einer Reinigungspaste aus dem Handel wisst ihr beim Einsatz eines solchen Hausmittels oder Chemie-Hacks ganz genau, welche Chemie bzw. Chemikalien darin enthalten sind. Nämlich garantiert nichts, was euch gefährlich werden könnte (so lange ihr das Kochsalz nicht löffelweise esst oder euch die Säure in die Augen spritzt – aber das versteht sich ja von selbst). Das ist doch ein beruhigender Gedanke, oder?
Und wie reinigt ihr Kupfer und Messing in eurem Haushalt?
Hast du das Experiment nachgemacht:
[poll id=“9″]
Wenn etwas nicht oder nur teilweise funktioniert haben sollte, schreibt es in die Kommentare. Ich helfe gerne bei der Fehlersuche!