Es ist Herbst geworden. Die Blätter an den Bäumen färben sich leuchtend gelb, orange oder rot. Am zurückliegenden herrlichen Oktober-Wochenende schien die Sonne vom strahlend blauen Himmel, und wir haben braune Walnüsse aus dem noch saftig grünen Gras unter den Nussbäumen gesammelt.
Aber warum sind all diese Dinge eigentlich bunt? Unter welchen Umständen erscheinen Stoffe uns farbig? Und warum sind andere Stoffe farblos oder sogar durchsichtig, wie Glas? Und warum glänzen wieder andere wie ein blanker Spiegel?
Wie wir Farben sehen
Um zu erfahren wie Farben, Transparenz und Glanz entstehen, solltest du wissen wie der menschliche Sehsinn funktioniert. Unsere Augen funktionieren nämlich ganz ähnlich wie eine Kamera: Wir „sehen“ Licht, welches durch unsere Augäpfel (deren Innenleben im Normalfall durchsichtig ist) auf die Netzhaut fällt und dort chemische Reaktionen auslöst. Die Produkte dieser Reaktionen führen zu elektrischen Signalen, die über den Sehnerv an das Gehirn weitergeleitet und dort zu einem Bild interpretiert werden. Die Ausgangsstoffe für die Reaktionen zur Erzeugung eines einfachen „Hell“-, aber auch von Farb-Signalen sind Abkömmlinge von Vitamin A bzw. Retinol, Varianten des „Seh-Stoffs“ Retinal.
Licht ist aber nicht gleich Licht, sondern kommt in unterschiedlichen Wellenlängen, d.h. mit unterschiedlicher Energie daher. Die Bandbreite möglicher Wellenlängen reicht dabei von extrem langwelligen (und energiearmen) Radiowellen bis zu energiereicher Röntgen- oder gar Gamma-Strahlung mit extrem kurzen Wellenlängen. Das menschliche Auge ist in der Lage einen kleinen Teil dieses Spektrums (eine grafische Darstellung des gesamten Licht-Spektrums findest du hier), das „sichtbare Licht“, wahrzunehmen und nach Wellenlängen zu unterscheiden.
Dazu gibt es in der Netzhaut drei verschiedene Arten von Zapfen-Zellen, welche nach ihrer jeweiligen Licht-Empfindlichkeit benannt sind. In den K-Zapfen reagiert eine Retinal-Variante mit kurzwelligem (violetten bis blauen), in den M-Zapfen mit mittelwelligem (blaugrünen bis gelben), und in den L-Zapfen mit langwelligem (orangegelben bis roten) Licht.
Das erinnert nicht umsonst an das gängige RGB-Farbschema zur Darstellung von Farben auf dem Computerbildschirm. Dieses nutzt schliesslich aus, was unser Gehirn tut: Es mischt sich aus den „blau“-, „grün“- und „rot“-Signalen der Netzhaut-Zapfen die gesehenen Farben zusammen. Da sich die Wellenlängenbereiche, die in den jeweiligen Zapfen Reaktionen auslösen, überlappen, erzeugt jede Wellenlänge ihre ganz eigene Kombination von Signalen, die das Gehirn auf 1 bis 2 Nanometer Licht-Wellenlänge genau bestimmen kann. Wir können damit 200 verschiedene Farbtöne sehen, jeden für sich in unterschiedlichen Sättigungen (Grau-Beimischungen).
Wenn die Netzhaut alle möglichen Farben gleichzeitig, oder zumindest die Signale für zwei „komplementäre“ Farben zusammen empfängt, macht das Gehirn daraus die Information „weiss“.
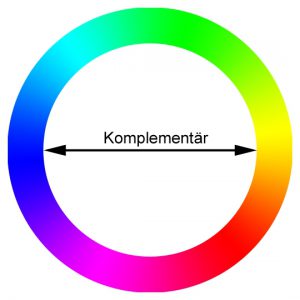
Im Farbkreis liegen Komplementärfarben einander gegenüber. Nebeneinander nehmen wir sie grösstmöglicher Kontrastwirkung wahr, während das Gehirn ihre Überlagerung als ‚weiss‘ interpretiert. (by Benutzer:Golden arms (von mir erstellt) CC-BY-SA-3.0 via Wikimedia Commons])
Weiss entspricht also keiner eigenen Licht-Wellenlänge, sondern einer Zusammenstellung verschiedener Wellenlängen. Wenn man eine Farbe also als bestimmte Wellenlänge sichtbaren Lichts definiert, ist Weiss keine Farbe.
Warum sehen Stoffe bunt aus?
Das Licht, das unseren Tag erhellt, kommt üblicherweise von der Sonne oder von elektrischen Leuchtmitteln und erscheint uns weiss. Tatsächlich ist dieses Tagelicht ein Gemisch von Lichtwellen aller Wellenlängen (nicht nur) im sichtbaren Bereich (für Sonnenlicht gelten einige Ausnahmen, aber das ist eine andere Geschichte!). Wer dafür einen Beweis möchte, besorge sich ein Prisma – das ist ein durchsichtiger, symmetrischer Gegenstand, der das weisse Licht in seine farbigen Bestandteile „bricht“.

Weisses Licht besteht aus Lichtwellen aller Farben: Das weisse Lichtbündel kommt von links unten und wird an der Oberfläche des Prismas teilweise reflektiert (ein kleineres Lichtbündel geht nach oben ab). Der Rest wird beim Austritt aus dem Prisma rechts abhängig von der jeweiligen Wellenlänge gebrochen: Die unterschiedlichen Farben der Lichtwellen werden sichtbar. (by Spigget (Own work) [CC BY-SA 3.0via Wikimedia Commons])
Elektronen bewegen sich im atomaren Hochhaus
Gras enthält Moleküle des Stoffs Chlorophyll, die aus verschiedenen Atomen zusammengesetzt sind. Diese Atome sind (wie alle Atome) mit „Wolken“ umgeben, welche ihre Elektronen enthalten. Im Molekül sind diese Wolken teilweise miteinander verbunden (die Atome „teilen“ ihre Elektronen miteinander, was sie zusammenhält: eine chemische Bindung entspricht solch einer „Gemeinschaftswolke“).
Jedes Elektron, das sich in solch einer Wolke befindet, hat eine ganz bestimmte, der Position „seiner“ Wolke entsprechende Energie, sodass die Elektronenhülle eines Atoms mit einem Hochhaus mit vielen von Elektronen bewohnten (und unbewohnten) Etagen vergleichbar ist. Analog zur klassischen Mechanik, gemäss der jemand, der nach oben will, Energie aufnehmen muss (die Treppe raufgehen ist anstrengend!), entsprechen die „oberen“ Wolken (oder „Orbitale“) im atomaren Hochhaus viel Energie, während „darunter“ Wolken mit weniger Energie zu finden sind.
Fällt nun ein Lichtquant (eine elementare Portion einer Lichtwelle) mit passender Energie auf ein Elektron in einer niedrigen Wolke, kann das Elektron mit dieser Energie in eine höher gelegene, leere Etage umziehen. Das Lichtquant entspricht also einer Schlüsselkarte für den Fahrstuhl, welche diesen veranlasst eine bestimmte Strecke nach oben zu fahren. Wenn sich genau dort eine Fahrstuhltür zu einer leeren Etage öffnet, kann das Elektron aussteigen und einziehen (wenn nicht, d.h. wenn der Fahrstuhl an seinem Ziel vor einer Wand halten würde, tritt es die Fahrt erst gar nicht an).
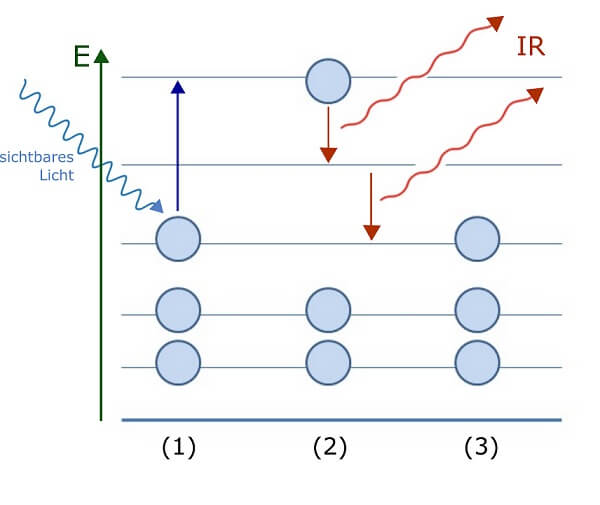
Anregung von Elektronen durch Lichteinfall: Das Schema stellt stark vereinfacht die Besetzung von Energieniveaus bzw. „Etagen“ im atomaren Hochhaus durch Elektronen (blaue Kreise) dar. Die Energie von sichtbarem Licht, das auf ein Atom im Grundzustand (1) fällt, entspricht genau dem markierten Abstand zum übernächsten Energieniveau (blauer Pfeil). Das Elektron absorbiert das Licht und zieht um in den angeregten Zustand (2). Der Weg zurück in den Grundzustand (3) verläuft für dieses Elektron in zwei Schritten über das Zwischengeschoss: Die entsprechenden Energien bzw. Licht-Wellenlängen liegen im Infrarot-Bereich und sind damit nicht sichtbar.
Die Energie des Lichtquants wird bei einem erfolgreichen Umzug vom Elektron absorbiert, also „geschluckt“, und wird erst wieder abgegeben, wenn das Elektron wieder in seine vorherige, tiefer gelegene Etage zurückkehrt (da es dazu häufig die „Treppe“ benutzt und die Energie auf dem Weg über Zwischengeschosse in kleineren, also langwelligeren, für uns unsichtbaren Portionen (im Infrarot-Bereich) abgibt, sehen wir das einmal absorbierte Licht oft nicht mehr wieder).
Das Farben-Hochhaus des Chlorophylls
Die Abstände zwischen den Wolken-Etagen eines Chlorophyll-Moleküls sind nun genau so beschaffen, dass vornehmlich „rote“ Lichtquanten die Elektronen zu einer höher gelegenen Aufzugtür und damit auf ein höheres Energieniveau befördern können. Wenn also weisses Licht auf das Chlorophyll im Gras fällt, werden darin enthaltene rote Lichtwellen von aufzugfahrenden Elektronen geschluckt. Alle übrigen Wellen werden unverrichteter Dinge wieder zurückgeschickt (reflektiert) und können in unser Auge gelangen und als „alles ausser rot“ empfangen werden. Und das Signal für „alles ausser rot“ entspricht für das Gehirn „grün“.
Manche Stoffe haben genügend verschiedene Wolken-Etagen, um Lichtwellen aller sichtbaren Wellenlängen zu schlucken, sodass keine davon unser Auge erreicht. Solche Stoffe erscheinen uns schwarz. Damit ist Schwarz streng genommen auch keine Farbe, sondern einfach „dunkel“ bzw. „kein Licht“. Andere Stoffe, die (mangels passender Etagen-Abstände) gar kein sichtbares Licht absorbieren können, erscheinen uns dagegen weiss.
Was farbig leuchtet
Selbst leuchtende Stoffe funktionieren übrigens genau umgekehrt. Die orange-gelb strahlenden Strassenlaternen, die man mancherorts findet, enthalten zum Beispiel Natrium-Atome, deren Elektronen mittels der Energie aus elektrischem Strom nach „oben“ umziehen, d.h. angeregt werden. Anschliessend fahren sie mit dem Fahrstuhl wieder nach „unten“ auf ihre Ausgangs-Etage (den Grundzustand) und geben dabei je ein Lichtquant mit der zugehörigen „gelben“ Wellenlänge ab (genauer gesagt gibt es im Natrium-Atom zwei sehr ähnliche „gelbe“ Abstände, die so überbrückt werden können).
Dass wir auch im gelben Licht einer Natrium-Lampe erkennen, dass ein Stück Papier weiss ist, obwohl es nur gelbes Natrium-Licht an unser Auge weiterschicken kann, haben wir übrigens der Photoshop-Software unseres Gehirns zu verdanken, die weiss, dass das Papier weiss zu sein hat und das empfangene Bild entsprechend bearbeitet.
Warum glänzen Metalle?
Ein Stück Metall besteht aus einem einzigen Riesenverbund gleichartiger Atome, die sich allesamt eine Riesen-Elektronenwolke teilen (Chemiker sprechen hier gern von einem „Elektronen-Gas“). Solch eine Wolke, die Etagen aller daran beteiligten Atome umfasst, kommt auf so viele dicht beieinander liegende Wolken-Etagen bzw. Energieniveaus, dass sich diese gar nicht mehr auseinanderhalten lassen. Entsprechend können sich die Elektronen des Metalls frei in der Riesenwolke bewegen und jede sichtbare Licht-Wellenlänge zum Umziehen absorbieren.
Demnach sollten Metalle also schwarz sein (nur sehr wenige Metalle, vornehmlich Gold und Kupfer, haben dennoch eine Farbe). Die freie Beweglichkeit erlaubt den Elektronen jedoch auch, ebenso leicht mit dem Fahrstuhl nach unten zu fahren wie sie nach oben gekommen sind, sodass sie ein absorbiertes Lichtquant bei ihrer Rückkehr in die untere Etage unverändert wieder abgeben können. Wenn das an einer polierten, d.h. gleichförmigen Oberfläche aus gleichartigen Atomen passiert, kommt das Licht genauso wieder zurück, wie es auf die Oberfläche getroffen ist.
Fällt solches Licht von einer Lichtquelle zuerst auf unser Gesicht, dann auf eine glatte Metalloberfläche und schliesslich zurück in unser Auge, sehen wir uns selbst in einem „Spiegel“. Deshalb wird „Metallglanz“ auch „Spiegelglanz“ genannt. Manche Mineralien (besonders solche, die viele Metallatome enthalten), sind reinen Metallen in ihrem Aufbau übrigens so ähnlich, dass sie ebenfalls Spiegelglanz zeigen, obwohl sie chemisch keine Metalle, sondern Ionenverbindungen sind.

Pyrit oder „Katzengold“ ist ein Mineral, das aus Eisen- und Schwefel-Ionen besteht. In seinem Aufbau ist es einem Metall dennoch so ähnlich, dass die glatte Oberfläche der Kristalle das Licht spiegelt. (by Rob Lavinsky, iRocks.com – CC-BY-SA-3.0 [CC BY-SA 3.0], via Wikimedia Commons)
Warum ist Glas durchsichtig?
Ein Stück Glas ist chemisch ähnlich aufgebaut wie ein Quarzkristall (der ist auch durchsichtig). Beide bestehen aus Silizium- und Sauerstoff-Atomen (in dem Glas, das wir im Alltag nutzen, kommen noch verschiedene andere Elemente dazu, die dem Glas weitere erwünschte Eigenschaften geben), die zu einem einzigen Riesenmolekül verbunden sind.
Im Kristall sind Atome und Bindungen in einem regelmässigen, sich stetig wiederholenden Gitter angeordnet (das macht einen Kristall aus), während die Atome im Glas zu einem ungeordneten Netzwerk verknüpft sind: Glas ist eine Flüssigkeit, die erstarrt ist, ohne dass die Teilchen darin sich zu einem Kristall hätten ordnen können – eine „unterkühlte Schmelze“.
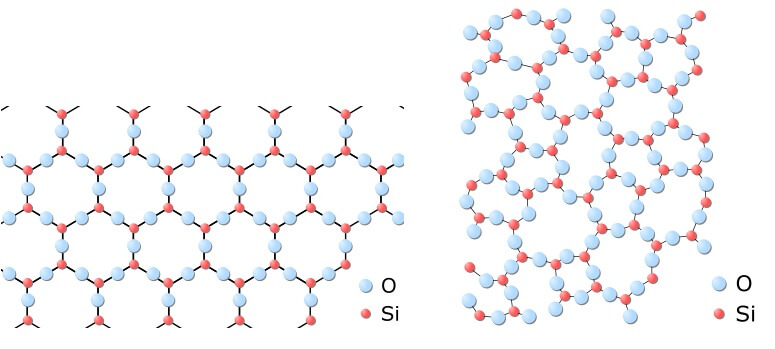
Aufbau von Quarzkristall und Quarzglas: Im Quarzkristall sind Silizium- (rot) und Sauerstoffatome (blau) regelmässig angeordnet. Im Glas bilden sie ein ungeordnetes Netzwerk. In beiden Stoffen sind die Elektronen fest an ihre jeweiligen Atome gebunden, sodass sie mit sichtbarem Licht nicht wechselwirken können.
Sowohl im Kristall als auch im Glas sind die Elektronen den einzelnen Atomen und Bindungen fest zugeordnet. Daraus ergeben sich grosse Abstände zwischen den Orbitalen bzw. „Wolken-Etagen“, die vornehmlich mit der Energie von UV-Licht überwunden werden können (tatsächlich ist Glas für UV-Licht „undurchsichtig“: Hinter Glas bekommt man so schnell keinen Sonnenbrand!). Licht mit Wellenlängen im sichtbaren Bereich kann hingegen keine Elektronen im Glas anregen (zum Umziehen bewegen) und geht somit unverändert hindurch.
Anders als in weissen, undurchsichtigen Stoffen wird das Licht in Glas zudem nicht nennenswert gestreut: Eine gleichmässige Streuung von Licht verschiedener Wellenlängen findet nur an Strukturen statt, deren Grösse in der Grössenordnung dieser Wellenlängen liegt – für sichtbares Licht sind das einige hundert Nanometer. Atome und kleine Moleküle, aber auch Atomgruppen in einem Kristall oder Glas sind hingegen mindestens 1000 mal kleiner.
Glas ist also durchsichtig, weil sichtbares Licht weder die richtige Wellenlänge hat, um von den fest verorteten Elektronen des Materials absorbiert, noch um darin gestreut zu werden.
Während es draussen zunehmend grauer und dunkler wird, werden die Oktober-Geschichten in Keinsteins Kiste ganz im Zeichen von Licht und Farben stehen. Macht euch auf spannende Entdeckungen und Phänomene gefasst!
Und was ist deine Lieblingsfarbe? Oder bist du vielleicht sogar farbenblind?










