Vor fünf Jahren machte erstmals die „ice and salt challenge“ um eine erstaunliche Kältemischung auf Youtube die Runde: Youtuber streuen sich Kochsalz auf die nackte Haut und fügen dann Eiswürfel hinzu. Das Ganze wird augenscheinlich sehr kalt – und die Challenge besteht darin, die Kälte lange genug zu ertragen.
Vor einem Jahr schlug diese Schnapsidee einmal mehr Wellen in den Medien:
Denn diese Challenge ist gefährlich!
Das Körpergewebe wird nämlich durch Kälte genauso verletzt wie durch Hitze: Eis und Salz werden gemeinsam so kalt, dass sogenannte Kaltverbrennungen bis zweiten oder dritten Grades die Folge sein können!
So fragt eine Leserin berechtigterweise: Warum tun Eis und Salz gemeinsam auf der Haut so weh?
Die Antwort lautet: Weil das Gemisch sehr kalt wird! Mischt man Eis und Kochsalz zu gleichen Teilen, kann die Temperatur des Gemischs auch in wärmerer Umgebung vom Schmelzpunkt reinen Wassers bei 0°C auf bis zu -17°C absinken!
Warum Eis mit Salz besonders kalt wird
Eigentlich gibt es in der Physik die Eigenschaft „Kälte“ nicht. Was wir als Kälte empfinden, ist das Resultat nicht vorhandener Wärme – also geringer Energie. Wenn etwas kalt wird, wird ihm also Energie entzogen. Und diese Energie darf nach den Gesetzen der Thermodynamik nicht einfach verschwinden.
Tut sie auch nicht: In einem Gemisch aus Eis und Kochsalz spielen mehrere Phänomene, die Wärme für ihre Zwecke vereinnahmen, zusammen:
Schmelzwärme: Das Schmelzen erfordert Energie!
Der Versuch, den ich letzten Freitag hier verbloggt habe, hat gezeigt: Schon der Vorgang des Schmelzens als solcher erfordert Energie, in diesem Zusammenhang „Schmelzwärme“ genannt, die dem schmelzenden Stoff und seiner Umgebung in Form von Wärme entzogen wird: Die Temperatur an der Oberfläche schmelzenden Eises stellt sich auf 0°C ein und steigt auch in wärmerer Umgebung nicht an.
Ebenso wenig nimmt sie weiter ab: Während am Schmelzpunkt, der auch Gefrierpunkt genannt wird, Wasserteilchen aus dem festen Eis-Gitter beweglich, also flüssig werden, ordnen sich andere, bewegliche Wasserteilchen wieder ins Gitter ein, werden also fest. Und dabei wird entsprechend Schmelzwärme freigesetzt.
Eis und Wasser befinden sich in einem Gleichgewicht, wie Le Châtelier es am Flughafen beschreibt!
Sobald sich dieses Gleichgewicht eingestellt hat, wird ebenso viel Schmelzwärme freigesetzt wie aufgenommen: Die Temperatur der beteiligten Stoffe ändert sich nicht.
Gelangt nun aus der Umgebung Wärme in dieses System, so verschiebt sich das Gleichgewicht weg von der Seite mit Wärme und damit hin zum flüssigen Wasser: Das Eis schmilzt.
Gefrierpunktserniedrigung: Wassermoleküle sind nicht multitaskingfähig!
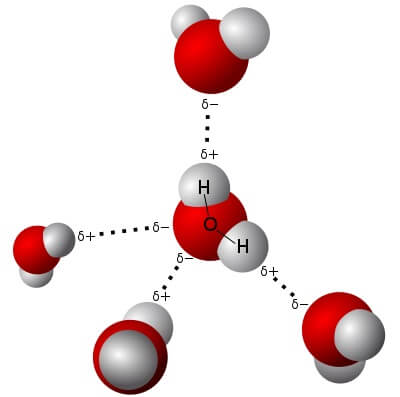
Der Gefrierpunkt einer Kochsalzlösung in Wasser ist niedriger als der Gefrierpunkt von reinem Wasser. Dabei gilt: Je höher die Konzentration der Lösung (d.h. je mehr Salz mit dem Wasser vermischt) ist, desto niedriger ist ihr Gefrierpunkt. Chemiker und Physiker nennen diesen Effekt „Gefrierpunktserniedrigung“.
Das Auflösen von Kochsalz, also Natriumchlorid, in Wasser bedeutet, dass sich die Natrium- und Chlorid-Ionen einzeln mit den Wassermolekülen mischen. Dabei wird jedes Ion von einer bestimmten Anzahl Wassermoleküle eingehüllt (Chemiker sagen „hydratisiert“). Diese Wassermoleküle, die mit dem Einhüllen von Ionen „beschäftigt“ sind, stehen damit nicht mehr für das Gefrieren – also der Umwandlung von flüssigem Wasser zu Eis, in der Gleichung oben von rechts nach links – zur Verfügung.
Gemäss dem Gesetz von Le Châtelier verschiebt sich das Gleichgewicht zum flüssigen Wasser, um den „Verlust“ an flüssigem Wasser auszugleichen: Es schmilzt nun mehr Eis, als es erstarrt. Damit wird mehr Schmelzwärme aufgewendet, als frei wird: Die Temperatur nimmt ab – und zwar so lange, bis sich ein neues Gleichgewicht eingestellt hat.
Das geschieht, wenn die Temperatur der Mischung den Gefrierpunkt von Salzwasser-Eis erreicht hat. Erst dann kann nämlich das Wasser mitsamt der eingehüllten Ionen zu einem festen Stoffgemisch erstarren – vorher bildet sich auch aus Salzwasser, wenn überhaupt, nur reines Wassereis.
Was macht die Kälte für uns gefährlich?
Die biochemischen Reaktionen, die in unseren Zellen und Geweben ablaufen, sind darauf ausgelegt, bei rund 37°C – in unserer Haut auch bei ein paar Grad darunter – abzulaufen und optimal zusammen zu spielen. Sinkt die Temperatur in einem Körpergewebe darunter, werden die Stoffwechselreaktionen zunächst langsamer. Das ist nicht weiter tragisch – so lange die komplexen, ebenfalls auf 37°C ausgelegten Molekülstrukturen, aus denen wir bestehen, durch das Abkühlen nicht in Mitleidenschaft gezogen werden.
Sobald das geschieht, gerät der Stoffwechsel der betroffenen Zellen spätestens bei der Wiederannäherung an die Betriebstemperatur (also wenn das Gewebe wieder warm wird), aus dem Tritt. Ab einem gewissen Grad des molekularen Durcheinanders veranlassen solche Zellen ihre Selbstzerstörung und begehen Selbstmord, bevor ihre Funktionsstörung ihre Nachbarn grossartig beschädigen können (Die Molekularbiologen nennen diesen programmierten Zelltod „Apoptose“).
Wenn den beschädigten Zellen jedoch nicht die Zeit bzw. die Energie bleibt, um die kontrollierte Selbstzerstörung zu durchlaufen – weil sie zum Beispiel zu schnell kalt oder heiss werden oder anderweitig drastisch beschädigt werden, kommt es zu einem zellulären GAU („grössten anzunehmenden Unfall“): Die Zellen werden unkontrolliert zerstört und neben Alarmsignal-Stoffen (einem molekularen „Hilfeschrei“) gelangen durch die zerstörten Zellwände Stoffe aus dem Zellinneren ins „Freie“, die den Nachbarzellen gefährlich werden können. Wir nehmen das als Entzündungsreaktion, Rötung, Schwellung, Schmerzen, und – wenn sichtbar grosse Gewebeabschnitte betroffen sind – als hässliche Wunden – Zell-Schrott eben – wahr (Molekularbiologen nennen diesen unkontrollierten Zelluntergang „Nekrose“).
Da in unkontrolliert entstandenem Zell-Schrott keine geordneten biochemischen Reaktionen und keine Blut- und damit Sauerstoffversorgung mehr möglich sind, kann „nekrotisches“, d.h. in einem „GAU“ untergegangenes Gewebe nicht mehr heilen. Ebenso wenig funktioniert in solchen Gewebebereichen die Immun-Abwehr, sodass nekrotisches Gewebe leicht von Bakterien oder anderen unliebsamen Gästen infiziert werden kann.
Dabei macht es praktisch keinen Unterschied, ob der zelluläre GAU von starker Hitze oder starker Kälte herrührt: Kalt-Verbrennungen und Heiss-Verbrennungen unterscheiden sich in ihren Folgen nicht wesentlich. Das Auftreten von unumkehrbar zerstörtem Gewebe durch Hitze oder Kälte entspricht damit einer Verbrennung dritten Grades. Und gemäss so mancher Bilder, die ich auf Youtube gesehen habe, scheinen Kalt-Verbrennungen zweiten bis dritten Grades mit einer Kältemischung, die zu lange auf der Haut verbleibt, problemlos machbar zu sein!
Wozu kalte Sachen weh tun
Der menschliche Körper schützt sich vor Kalt- ebenso wie vor Heiss-Verbrennungen: Die Haut ist mit Schmerz-Rezeptoren ausgerüstet, die bei Hitze- und Kältereizen schmerzhaften Grossalarm auslösen und dafür sorgen, dass wir uns reflexartig von der Hitze- oder Kältequelle entfernen, bevor es zum Schlimmsten kommt.
Normalerweise jedenfalls. Wer sich an der „ice- and salt-challenge“ beteiligt, bemüht sich darum, genau diesen Schutzreflex zu unterdrücken. Je „erfolgreicher“ man darin ist, desto gefährlicher werden die Verletzungen, die daraus resultieren können!
Ich rate daher dringend vom Nachmachen ab!
Wie ihr trotzdem mit der Gefrierpunktserniedrigung experimentieren könnt
Anstatt ein Eis-Kochsalz-Gemisch auf eure Haut zu bringen, könnt ihr Eiswürfel oder Schnee und Salz ebenso gut in einem Behälter (am besten aus Kunststoff oder Edelstahl – Glas und Keramik können bei schneller Temperatur-Änderungen schonmal zerspringen!) miteinander mischen und die Temperaturabsenkung mit einem Thermometer messen.
Dabei könnt ihr gleich eure eigene Challenge veranstalten: Wer erreicht mit seinem Eis-Kochsalz-Gemisch die niedrigste Temperatur?
Wenn ihr unbedingt selbst fühlen möchtet, wie kalt das Gemisch wird, dann nehmt die Finger gleich wieder weg, sobald es euch unangenehm wird (das ist in der Regel innerhalb von Sekunden der Fall)!
Chemiker nutzen solche „Kältemischungen“ aus Eis und Kochsalz übrigens gerne im Labor, um Reaktionsgefässe ohne aufwändige Elektrogeräte (ausser der Eiswürfelmaschine bzw. dem Tiefkühlfach) wirksam zu kühlen: So können Reaktionen, bei denen sehr viel Energie frei wird, im Zaum gehalten oder gasförmige Stoffe im Gefäss verflüssigt werden.
Seid ihr auch schon mit der „ice-salt-challenge“ in Berührung gekommen oder habt gar daran teilgenommen? Oder habt ihr schonmal eine Kältemischung zum Kühlen verwendet?