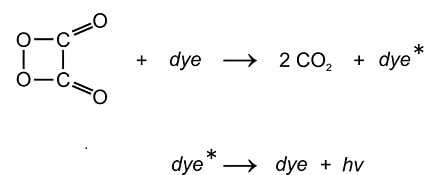Dieser Beitrag erscheint anlässlich des ersten Blogging Day – organisiert vom wunderbaren Bloggerforum auf meinbloggerforum.de – und neu auch im Rahmen der Kürbis-Blogparade auf „Gesundheit lenkt Energie“
Halloween ist ein Inbegriff für lange, dunkle Nächte, für Grusel und Geistererscheinungen, die gemäss altem Brauch in der Nacht vor Allerheiligen auf Abstand gehalten werden sollen. In der heutigen Zeit bedeutet Halloween jedoch vielmehr Partyspass und angenehm-schauerliche Events.
Ob es um historische Schreckgespenster oder neuzeitliche Party-Geister geht, beim nächtlichen Spuk sind rätselhafte Lichteffekte, geisterhaftes Leuchten und kaltes Feuer, unverzichtbar.
Diese ‚Geschichte‘ lüftet das Geheimnis von drei Sorten gespenstischer Lichtphänomene, mit welchen du auch deiner Halloween-Party einen magischen Gänsehauteffekt verleihen kannst.
Fluoreszenz
Kathi und Reto arbeiten eifrig an ihrer Halloween-Dekoration. Reto ist in der Küche beschäftigt, möchte einen Kürbis schnitzen, als plötzlich ein derber Fluch ertönt.
„Das Messer ist abgebrochen“, erklärt Reto, als Kathi aufgeschreckt herbeigestürzt kommt, „so wird das nichts mit dem Schnitzen…“
„Dann nimm doch den hier, und zeichne dem Kürbis das Gesicht einfach auf.“ Kathi drückt ihrem Freund einen Filzschreiber in die Hand und ist schon wieder im Wohnzimmer verschwunden.
Kurz darauf tönt es aus der Küche: „Was soll denn das? Die Tinte sieht man ja gar nicht!“
„Du wirst sie schon sehen!“, ruft Kathi zurück, während sie eben eine ziemlich schwarzviolette Glühbirne in die Lampe auf der Fensterbank schraubt, „zeichne einfach und dann bring den Kürbis hier rüber!“
Was hat Kathi vor?
Die dunkelblaue, fast schwarz erscheinende Lampe strahlt nur wenig sichtbares, dafür aber umso mehr ultraviolettes Licht ab. Die unsichtbare Tinte des Filzstifts, mit dem Reto das Kürbisgesicht zeichnen soll, enthält eine fluoreszierende Substanz. Das ultraviolette bzw. „Schwarz“-Licht kann diese Substanz zum Leuchten, zur Fluoreszenz anregen und das Gesicht auf dem Kürbis sichtbar machen.

Fluoreszenz: Dieses Kürbisgesicht wird erst unter UV-Licht (380 nm) offenbart!.
Was ist Fluoreszenz?
Das Leuchten unter Schwarzlicht, das man auch Fluoreszenz nennt, kommt im Prinzip genauso zu Stande wie die Farben, die wir bei sichtbarem Licht sehen: Auf den fluoreszierenden Stoff fällt Licht, einzelne Lichtquanten werden von Elektronen in der Elektronenhülle der Atome darin geschluckt und zum Umzug auf ein passendes, höheres Energieniveau ‚verwendet‘.
Die meisten Lichtquanten aus Kathis schwarzer Glühbirne haben jedoch besonders kurze Wellenlängen und sind damit für das menschliche Auge unsichtbar (man findet dieses Licht im Lichtspektrum jenseits des violetten sichtbaren Lichts, weshalb man es „ultraviolettes“, kurz UV-Licht nennt). Eine kürzere Wellenlänge bedeutet jedoch auch eine grössere Energie, mit welcher ein UV-Lichtquant ein Elektron auf eine besonders hohe Energie-Etage in der Elektronenhülle befördern kann.
Von dort kann das Elektron in zwei Schritten auf seine Ausgangsetage – in den Grundzustand – zurückkehren („die Treppe benutzen“). Das Geheimnis des Fluoreszierens beruht dabei auf der Länge dieser beiden Schritte.
In einem fluoreszierenden Molekül ist einer dieser Schritte nämlich so klein, dass das Elektron bei seiner Überwindung nur wenig Energie, also ein Lichtquant mit sehr langer Wellenlänge abgeben muss. Solches Infrarot-Licht ist für das menschliche Auge ebenfalls unsichtbar. Der andere Schritt ist folglich um einiges länger – so lang, dass das Elektron bei seiner Überwindung ein sichtbares Lichtquant abgibt: Dessen Energie ist hoch genug, um nicht infrarot zu sein, aber klein genug, um auch nicht ultraviolett zu sein.
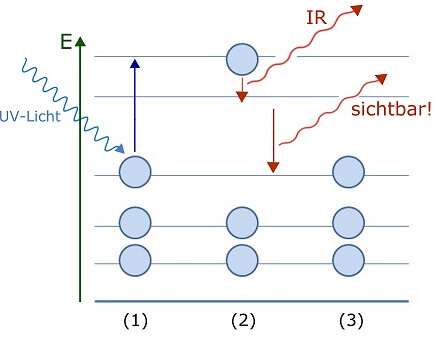
Fluoreszenz: Elektronen werden mittels UV-Licht in einen hoch angeregten Zustand gebracht (1). Das Elektron kehrt in zwei Schritten in den Grundzustand (3) zurück Dabei entspricht ein Schritt der Abgabe eines unsichtbaren Infrarot-Lichtquants, der andere der Abgabe eines sichtbaren Lichtquants.
Retos Fluoreszenz-Filzschreiber-Farbstoff fluoresziert gelblich: Die Elektronen in dessen atomarem Hochhaus überwinden also auf ihrem Rückweg in den Grundzustand einen Abstand, der einem gelben Lichtquant entspricht. Andere Moleküle können jedoch andere Abstände haben. Ein Rubin (der nicht nur als Laser-Lichtquelle taugt), fluoresziert zum Beispiel rot, wieder andere Stoffe blau oder grün.
Welche Stoffe können fluoreszieren?
LED-Lampen (also Leuchtdioden, z.B. in Taschenlampen), die UV-Licht leuchten, bekommt man heute preiswert (in der Schweiz für unter 10 CHF) im Elektro-Handel. UV-Leuchtstoffröhren oder „Energiespar“-Lampen sind unter Umständen etwas teurer. Aber mit beiden lässt sich leicht herausfinden, welche Stoffe in UV-Licht fluoreszieren.
Einer der alltäglichsten fluoreszierenden Stoffe ist wahrscheinlich Kalk (Calciumcarbonat, CaCO3), der mit UV-Licht beleuchtet ebenso hellgelblich fluoresziert wie Retos Spezialtinte. So zeigt ein Rundgang mit der UV-Lampe durch das abgedunkelte Badezimmer deutlich, wo nachlässig geputzt wurde und enttarnt selbst bei normalem Licht unsichtbare Kalkablagerungen. Auch der Kalk in unseren Zähnen fluoresziert weisslich.
Waschmittel enthalten häufig sogenannte optische Aufheller. Das sind Stoffe, die bei der Wäsche in Textilien haften bleiben und in UV-Licht, zum Beispiel in der Disco, für das bläulich-weisse Leuchten weisser T-Shirts verantwortlich sind.
Mit Absicht werden fluoreszierende Stoffe in Geldscheine und Ausweisdokumente eingearbeitet um ihre Fälschungssicherheit zu erhöhen. Mit UV-Licht beleuchtet offenbaren sie häufig überraschendes (Geheimtipp: Der EU-Führerschein (die Plastikkarten-Version) ist besonders spektakulär!).
Fluoreszenz für dein Halloween:
Mit einem UV-Filzschreiber lässt sich nahezu alles zeichnen und mit UV-Leuchtmitteln („Schwarzlicht“) gespenstisch in Szene setzen – als künstlerische Bearbeitung der Dekoration im Partyraum oder als raffinierte Details auf Kostüm und Accessoires.
Nur die eigene Haut und zum Essen gedachte Lebensmittel sollten nicht auf diese Weise dekoriert werden: UV-Filzschreiber enthalten Lösungsmittel wie Xylol, die gesundheitsschädlich sein können (Reto und Kathi wollen die Schale ihres Kürbis‘ natürlich nicht essen, sodass sie die getrost bemalen können!).
Dafür gibt es eine breite Palette von Kosmetik- und Bodypainting-Produkten mit fluoreszierenden Farbstoffen, die für ein wahrhaft gruseliges Make-Up verwendet werden können, wenn eine Halloween-Party mit Schwarzlicht ansteht. Zudem dürfte dort auch das klassische Bettlaken-Gespenst zum geisterhaft-glühend weissen Blickfang werden.
Phosphoreszenz
Da UV-Leuchtmittel doch recht teuer sind und im Dauerbetrieb laufend Strom verbrauchen, hat Kathi sich noch etwas ausgedacht, um ihren Kürbis auch bei ausgeschalteter Lampe schaurig glühend in Szene zu setzen. In der Halloween-Ecke im Kaufhaus hat sie deshalb nach Artikeln mit der Kennzeichnung „glow in the dark“, zu Deutsch „leuchtet im Dunkeln“, gesucht.
Und das ganz ohne Stromanschluss. Zumindest fast – denn bevor solche Gegenstände im Dunkeln leuchten, müssen sie von einer hellen Lichtquelle – der Sonne oder einer Lampe – eine Zeit lang beleuchtet werden. Wenn man das Licht dann ausmacht, leuchten sie viele Minuten, wenn nicht sogar Stunden hell gelb-grünlich vor sich hin, ohne warm zu werden oder gar Strom zu brauchen.

Phosphoreszenz: Dieses Arrangement stand zuvor auf dem Balkon, um in der Sonne aufzuladen. Plötzlich tönte es von dort: „KAAATHII! Hast du den Kürbis gesehen? DEN willst du garantiert nicht mehr essen!! — Keine Sorge, Reto: Diese Maden sind aus Kunststoff und phosphoreszieren sogar im Dunkeln!.
Wie funktioniert das?
Diese Erscheinung, Phosphoreszenz genannt, ist wiederum eine besondere Eigenschaft bestimmter Stoffe. Auch in diesen schlucken Elektronen Lichtquanten (in diesem Fall sichtbares Licht aus der hellen Lichtquelle) und ziehen damit auf ein höheres Energieniveau um. Das besondere an diesen Energieniveaus ist jedoch, dass die Elektronen extrem lange Zeit darin verbleiben können (Minuten oder gar Stunden, während sie in ’normalen‘ Atomen und Molekülen binnen winziger Sekundenbruchteile in den Grundzustand zurückkehren!).
So können die Elektronen phosphoreszierender Stoffe von sichtbarem Licht angeregt werden und die Energie der geschluckten Lichtquanten speichern, bis das Licht aus ist und die Party läuft, um sie dann im Laufe der Zeit in Form von Lichtquanten wieder abgeben, die die gleiche Wellenlänge haben wie das zuvor geschluckte Licht.
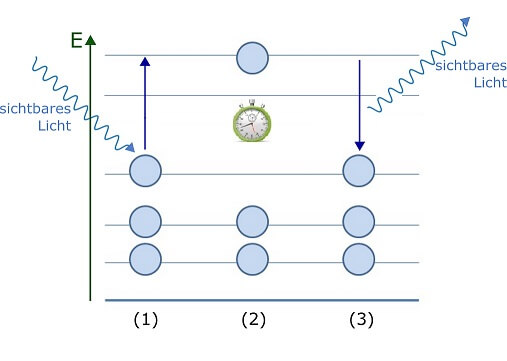
Phosphoreszenz: Elektronen werden durch sichtbares Licht angeregt (1). In einem phosphoreszierenden Stoff können Elektronen eine längere Zeit im angeregten Zustand verbleiben (2), ehe sie die zur Anregung geschluckte Energie wieder abgeben (3).
Welche Chemikalien/Stoffe phosphoreszieren?
Die „Phosphoreszenz“ ist nach dem Element Phosphor (genauer gesagt nach weissem Phosphor) benannt, welcher einen Glow-in-the-dark-Effekt zeigt. Dessen Entdecker ahnte jedoch nicht, dass es sich dabei vielmehr um eine Form der Chemolumineszenz (siehe unten) handelt. Die Leucht-Farbstoffe in Glow-in-the-Dark-Accessoires bestehen meist aus Kristallen, in welche einzelne Fremdatome eingebaut sind.
Phosphoreszenz für dein Halloween:
Ob als fiese Maden, geisterhafte Spinnen oder weithin sichtbares Vampir-Gebiss: Glow-in-the-dark-Accessoires gibt es zu Halloween in reichlicher Auswahl und kommen in möglichst dunkler Umgebung besonders gut zur Geltung. Für ganz Kreative gibt es sogar Malfarben, die phosphoreszierende Stoffe enthalten. In jedem Fall sollten sie unmittelbar vor ihrem Einsatz kräftig mit Lichtquanten aus einer Lampe „aufgeladen“ werden.
Chemolumineszenz
„Und was machen wir mit dem anderen Kürbis, den ich schon ausgehöhlt habe?“, fragt Reto schliesslich. „Wenn wir da eine Kerze hineintun, wird immer einer von uns im Wohnzimmer aufpassen müssen, wenn sie brennt…“
„Ich weiss etwas Besseres“, wirft Kathi rasch ein, bevor Reto noch anfügen kann ‚…und ich weiss auch schon, wer das sein wird…‘.
„Das hier habe ich auch im Kaufhaus gefunden“, erklärt sie und hält einen kleinen Kunststoffstab in die Höhe, der mit einer knallroten Flüssigkeit gefüllt ist. „Einmal knicken, und wir haben – hoffentlich für ein paar Stunden – kaltes Feuer: Gruselig rot leuchtend und ganz ohne Strom und Brandgefahr!“

Chemolumineszenz: Ein Knicklicht (links im Vordergrund) sorgt für gruselige Kürbisbeleuchtung ganz ohne Feuergefahr!
Wie will Kathi das denn hinbekommen?
Was Kathi da in der Hand hält, ist ein sogenanntes Knicklicht – ein Leuchtstab. Der besteht eigentlich aus zwei Stäben ineinander. Der innere Stab ist aus dünnem Glas und enthält den Stoff Wasserstoffperoxid (H2O2). Darum herum ist eine durchsichtige Hülle aus flexiblem Kunststoff. Im Zwischenraum zwischen Glasstab und Kunststoffhülle sind ein Stoff mit dem Name Bis(2,4,5-trichlorphenyl-6-carbopentoxyphenyl)oxalat, kurz CPPO, und ein Farbstoff, der fluoreszieren kann, eingeschlossen. Da Kathis Knicklicht rot aussieht, ist der Farbstoff darin wahrscheinlich ein Rhodamin (es gibt auch passende Farbstoffe in fast allen anderen Farben).
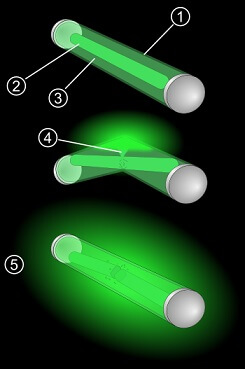
Aufbau eines Knicklichts: (1) Kunststoffröhre: schliesst die Chemikalien sicher ein (2) Wasserstoffperoxid im Glasröhrchen (3) CPPO und ein Fluoreszenzfarbstoff (4) Wasserstoffperoxid tritt aus (5) wenn alle Stoffe vermischt sind, leuchtet der Stab (by Pbroks13 (CC-BY 3.0) auf Wikimedia Commons))
Wenn Kathi das Kunststoffrohr knickt, wird es nachgeben, aber nicht kaputt gehen. Anders das Glasrohr in dessen Innerem: Es wird zerbrechen, sodass alle Stoffe miteinander vermischt werden.
Sobald das geschieht, reagiert CPPO mit Wasserstoffperoxid zu zwei neuen Stoffen: 1,2-Dioxetandion und Phenol.
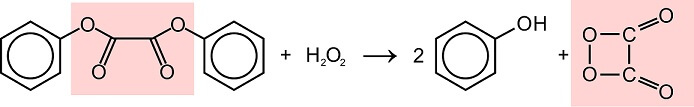
Ein „erhellendes“ Molekül entsteht: CPPO reagiert mit Wasserstoffperoxid zu Phenol und 1,2-Dioxetandion (nach cyalume-reactions by Smurrayinchester (CC-BY-SA 3.0 auf Wikimedia Commons))
Das 1,2-Dioxetandion ist ein besonderes Molekül: Es enthält einen Ring aus nur 4 Atomen. Wer einen Molekülbaukasten hat und so etwas nachbauen will, wird feststellen, dass es einiges an Nachdruck und Fingerspitzengefühl braucht, um einen Ring aus 4 Atomen zusammen zu setzen. Wie in solch einem Modell steckt auch in dem wirklichen Molekül mit dem Vier-Ring eine ganze Menge Energie, die es zu einer speziellen chemischen Reaktion mit einem Fluoreszenz-Farbstoff befähigt: Es bringt den Farbstoff zum Leuchten!
Man nimmt an, 1,2-Dioxetandion „nimmt“ sich dazu ein einzelnes Elektron aus der Hülle eines Farbstoff-Moleküls und „gibt“ es anschliessend zurück – allerdings auf eine höhere Etage im atomaren Hochhaus. Das 1,2-Dioxetandion betätigt sich also als „Aufzug“, der ein Elektron des Farbstoffs mit Energie ausstatten und in einen angeregten Zustand versetzen kann. Es übernimmt damit die Rolle des UV-Lichts bei der Fluoreszenz.
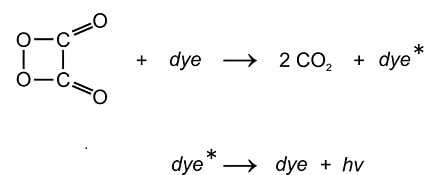
Chemolumineszenz: 1,2-Dioxetandion nimmt ein Elektron eines Fluoreszenzfarbstoffs („dye“) und gibt es auf ein höheres Energieniveau zurück. Dabei zerfällt 1,2-Dioxetandion in zwei Moleküle Kohlendioxid. Der Farbstoff im angeregten Zustand („dye*“) gibt die so erhaltene Energie in Form eines sichtbaren Lichtquants („hv“) ab: Der Farbstoff „fluoresziert“ ohne dass UV-Licht zur Anregung nötig ist. (nach cyalume-reactions by Smurrayinchester (CC-BY-SA 3.0 auf Wikimedia Commons))
So kehrt ein angeregtes Elektron wie bei der Fluoreszenz alsbald in den Grundzustand zurück und strahlt dabei ein sichtbares Lichtquant ab. Ein Knicklicht „fluoresziert“ also ohne Bestrahlung mit UV-Licht. Da es die Energie für sein Leuchten stattdessen aus einer chemischen Reaktion bezieht, nennt man diesen Vorgang „Chemolumineszenz“.
Chemolumineszenz für dein Halloween:
Knicklichter in allen Farben gibt es für wenige Rappen oder Cent zu kaufen. So lange du sie sachgemäss verwendest, d.h. ihre Kunststoffhülle nicht beschädigst oder sie grosser Hitze (offenes Feuer) aussetzt, sind die darin eingeschlossenen Chemikalien auch nicht gefährlich (entgegen mancher Gerüchte enthalten Knicklichter schliesslich KEINE radioaktiven Stoffe!).
Bedenke aber: Einmal geknickt wird ein Knicklicht bestenfalls einige Stunden leuchten, bis das enthaltene CPPO verbraucht ist – die Reaktion lässt sich, einmal gestartet, nicht mehr anhalten. Dafür leuchten verbrauchte Knicklichter in UV-Licht weiter: Der enthaltene Farbstoff wird schliesslich nicht aufgebraucht und kann auch „normal“ fluoreszieren!
Fazit
Ob mit Schwarzlicht, Glow-in-the-Dark oder erleuchtender Chemie: Zahlreiche geisterhafte Lichteffekte können uns eine gruselige Zeit bescheren. In diesem Sinne: Happy Halloween!
Und mit welchem gespenstischen Lichtzauber sorgst du für ein echt gruseliges Halloween-Erlebnis?




(*) und wird für Jugendliche ab 15 Jahren empfohlen.